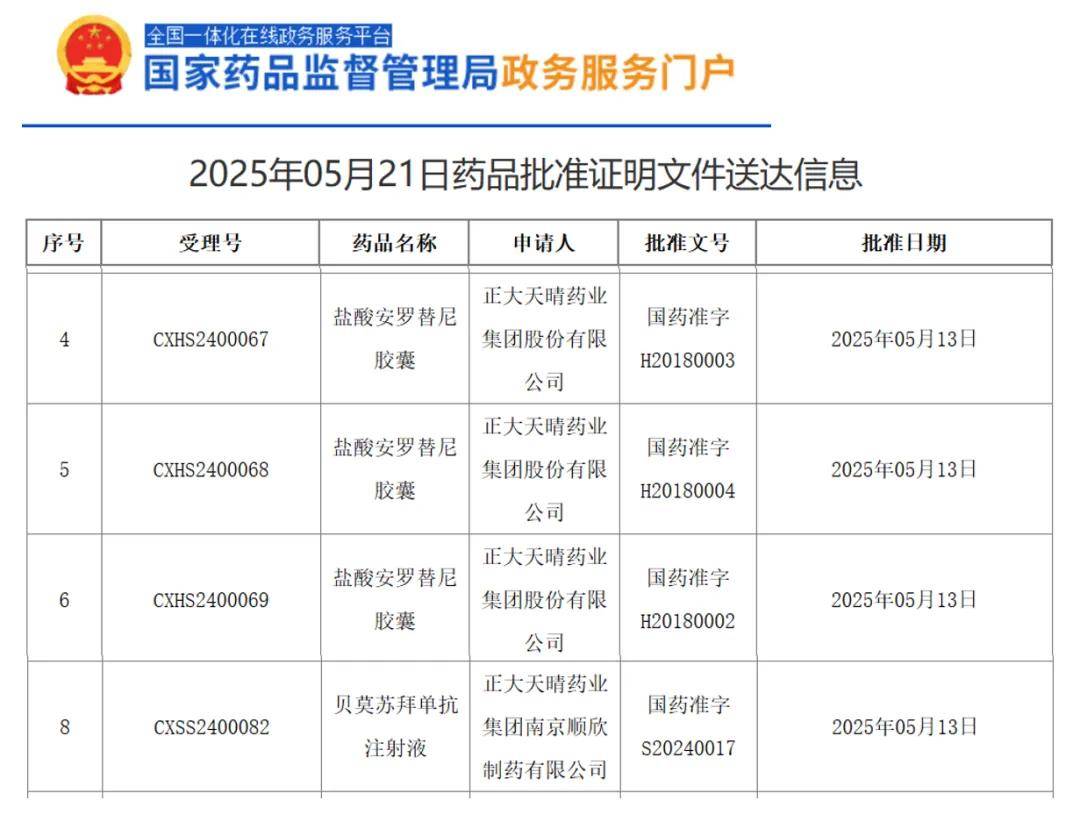
2025 年 5 月 21 日,国家药品监督管理局(NMPA)官网公示,正大天晴旗下贝莫苏拜单抗的新适应症获批上市,联合安罗替尼用于一线治疗晚期不可切除或转移性肾细胞癌(RCC)患者。
相关数据
2024 年ESMO年会公布了一项贝莫苏拜单抗联合安罗替尼对比舒尼替尼一线治疗晚期肾透明细胞癌的III期临床研究(ETER100)数据。
研究设计
ETER100研究为一项开放标签、随机对照、多中心的III期临床试验(NCT04523272),旨在评估贝莫苏拜单抗联合安罗替尼一线治疗晚期肾透明细胞癌患者的有效性和安全性。主要入组标准为既往未接受过系统性抗肿瘤治疗的转移性或不可切除的透明细胞型肾细胞癌患者。入组患者按照 1:1 比例随机分为两组,分别接受贝莫苏拜单抗(1200 mg,iv,d1,q3w)联合安罗替尼(12 mg,po,qd,d1-14,q3w)治疗(试验组)或舒尼替尼单药(50 mg,qd,d1-28,q6w)治疗(对照组),直至疾病进展或出现不可耐受的毒性反应等。主要研究终点为盲态独立中心审查(BIRC)评估的无进展生存期(PFS)。次要研究终点为研究者评估的PFS、总生存期(OS)、客观缓解率(ORR)、缓解持续时间(DoR)、疾病控制率(DCR),安全性等。分层因素:IMDC预后风险分级(低危 vs. 中危 vs. 高危)。
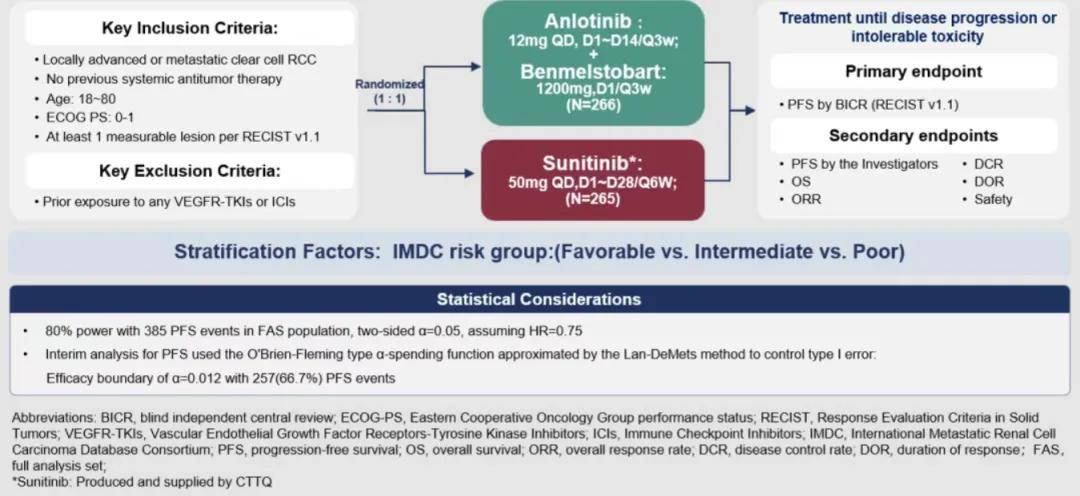
▲研究设计
研究结果
截至数据截止日期(2024 年 01 月 31 日),共有 687 例患者接受了入组筛选,其中 531 例进行了随机分组,266 例患者被分配到试验组,265 例患者被分配到对照组。共有 528 例患者接受了试验药物治疗(试验组 264 例,对照组 264 例),并进行了安全性评估。共有 527 例患者进行了疗效评估(1 例接受舒尼替尼治疗的患者因为“非透明细胞肾细胞癌”严重违背方案而被排除在疗效分析之外)。在截止日期,试验组和对照组分别有 138 例和 209 例患者终止治疗,终止治疗的主要原因为疾病进展。
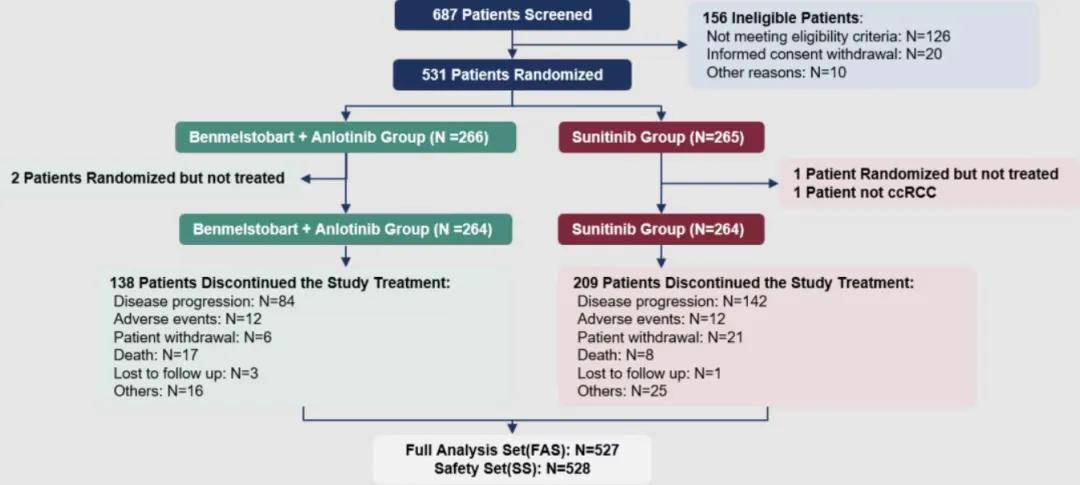
▲入组流程
与舒尼替尼相比,贝莫苏拜单抗联合安罗替尼一线治疗显著延长晚期肾细胞癌患者的PFS,中位PFS分别为 18.96 个月 vs. 9.76 个月(HR,0.53 [95% CI,0.42-0.67];P<0.0001),大部分亚组可以从贝莫苏拜单抗联合安罗替尼治疗中获得显著PFS获益。与舒尼替尼相比,贝莫苏拜单抗联合安罗替尼显著提高患者ORR(71.6% vs. 25.1%,P<0.001)。两组中位OS均未达到,贝莫苏拜单抗联合安罗替尼组显示出OS获益趋势(HR, 0.66; 95% CI, 0.48-0.92; P = 0.0673)。
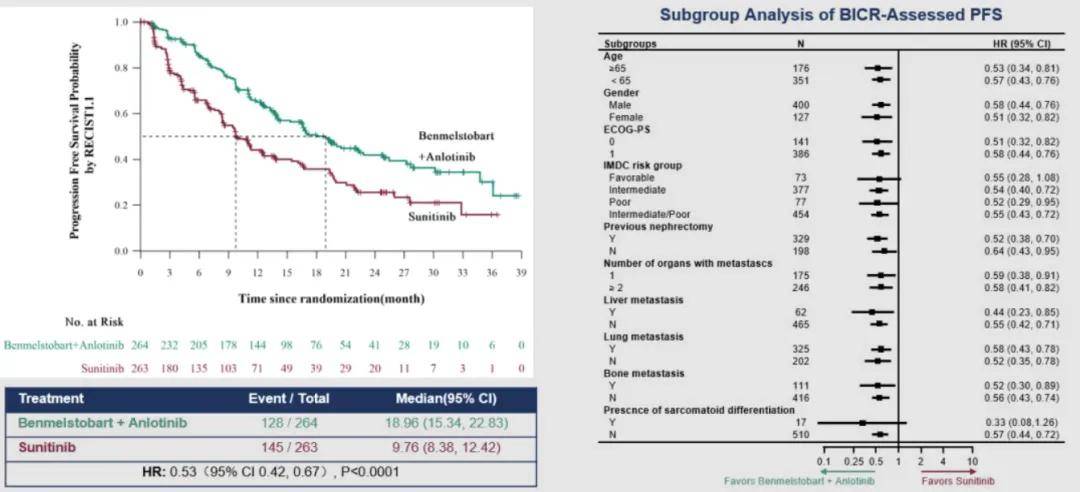
▲PFS(左)和亚组分析(右)
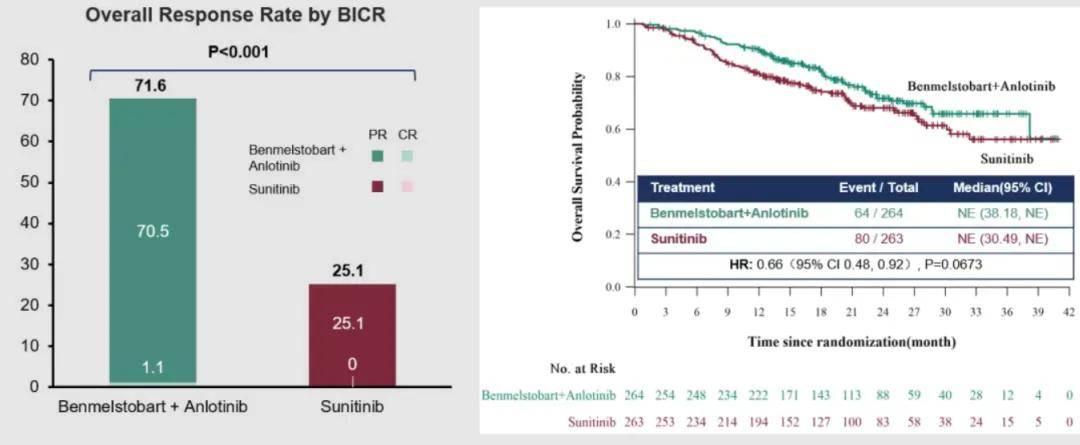
▲ORR(左)和OS(右)
安全性数据
试验组与对照组 ≥3 级治疗期间出现的不良事件(TEAEs)的发生率分别为 75.00% 和 74.62%;≥3 级治疗相关的不良事件(TRAEs)的发生率分别为 67.42% 和 65.91%。贝莫苏拜单抗联合安罗替尼组常见的 ≥3 级TRAEs为高血压、蛋白尿、高甘油三酯血症、手足综合征等。舒尼替尼组常见的 ≥3 级TRAEs为血小板计数降低、高血压、中性粒细胞计数降低、白细胞计数降低等。贝莫苏拜单抗联合安罗替尼显示出良好的安全性,联合治疗与每种药物已知安全性一致。
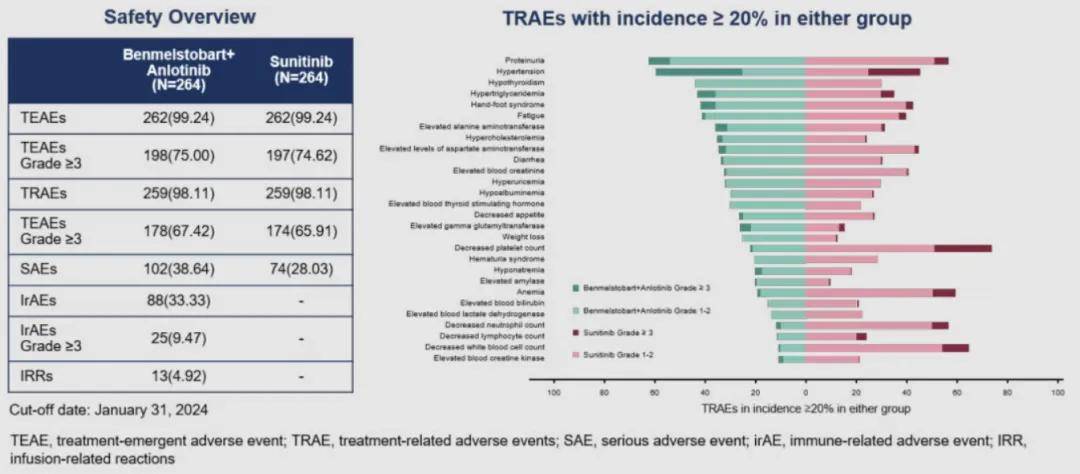
▲安全性汇总和最常见的TRAE(≥20%患者)
相关背景
肾细胞癌
肾细胞癌(RCC)是最常见的泌尿系统肿瘤之一。约 20-30% 的肾癌患者诊断时已出现局部或远处转移,对于原发性非转移的肾细胞癌患者,即使接受治愈性为目的的肾切除术,仍然会有约 20% 的患者 5 年内出现复发或转移。近二十年来,晚期肾细胞癌的一线治疗取得了很大的进展,抗血管生成酪氨酸激酶抑制剂(TKI)如舒尼替尼和培唑帕尼一线治疗晚期肾细胞癌给患者带来生存获益,但大多数患者会随着耐药的出现而发展为疾病复发。
贝莫苏拜单抗(安得卫®,TQB2450)
贝莫苏拜单抗是我国自主研发的一款全新序列的创新人源化抗PD-L1单克隆抗体,通过靶向作用于肿瘤细胞表面的PD-L1受体阻止肿瘤细胞发生免疫逃逸,维持T细胞的肿瘤杀伤活性;同时,能够阻断PD-L1与T细胞表面B7.1的结合,全面激活T细胞的抗肿瘤作用。而小分子多靶点酪氨酸激酶抑制剂安罗替尼在抑制肿瘤血管生成,诱导肿瘤血管正常化及调控血管基质方面发挥重要作用,可通过增加药物在肿瘤组织中的分布,降低免疫抑制性而增强免疫效应性细胞的浸润和激活,与免疫检查点抑制剂联合发挥协同增效的抗肿瘤效果。
▲贝莫苏拜单抗
2024 年 5 月 9 日,由正大天晴药业集团股份有限公司自主研发生产的贝莫苏拜单抗注射液(安得卫®)正式获得国家药品监督管理局(NMPA)批准上市,首个适应症为联合盐酸安罗替尼胶囊、卡铂和依托泊苷用于广泛期小细胞肺癌(ES-SCLC)患者的一线治疗。
2024 年 11 月 27 日,正大天晴宣布,贝莫苏拜单抗注射液联合盐酸安罗替尼胶囊的新适应症获国家药品监督管理局(NMPA)批准上市,用于既往系统性抗肿瘤失败且不适合进行根治性手术治疗或根治性放疗的非微卫星高度不稳定(非MSI-H)或非错配修复基因缺陷(非dMMR)的复发性或转移性子宫内膜癌的治疗。
▲贝莫苏拜单抗ES-SCLC适应症获批
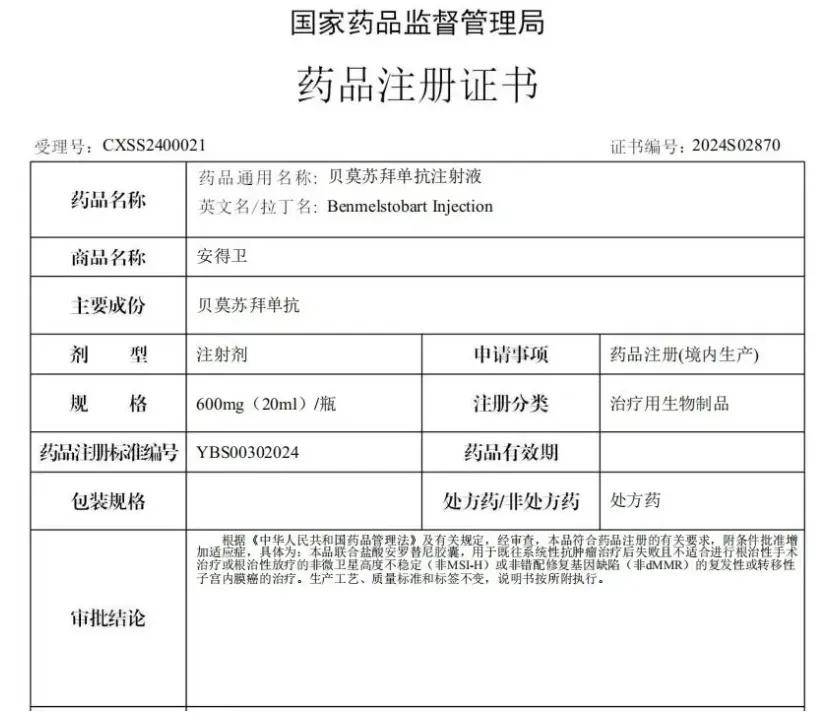
▲NMPA批准贝莫苏拜单抗新适应症上市
2024 年 11 月,贝莫苏拜单抗联合安罗替尼用于腺泡状软组织肉瘤患者的治疗被CDE纳入突破性治疗品种,有望更早解决中国病患未满足的临床需求。此外,该联合疗法正在开展多项临床III期试验,涵盖一线非小细胞肺癌、非小细胞肺癌放化疗后的维持治疗等多个重要领域。正大天晴将积极探索“免疫+抗血管生成”联合疗法的治疗潜力,为广大患者在肿瘤精准治疗的新时代提供更多的治疗选择,带来更多治疗的希望。
参考文献:
[1]NMPA官网.
[2]2024ESMO会议摘要.
[3]正大天晴官网.
[4]CDE官网.





