2025年版第6期《全球药研新动态》
新鲜出炉!

全球新药批准概况
2025年4月上半月,美国食品药品监督管理局(FDA)批准新药申请(NDA)4个,其中包括1个新分子实体药物(NMEs)。欧洲药品管理局(EMA)批准上市申请(MAA)0个。日本医药品医疗器械综合机构(PMDA)批准新药申请0个。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
全球药品研发概况
2025年4月上半月,全球进入注册前阶段的新药有2个,其中包括2个新化学实体药物(NCEs)。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品注册申报概况
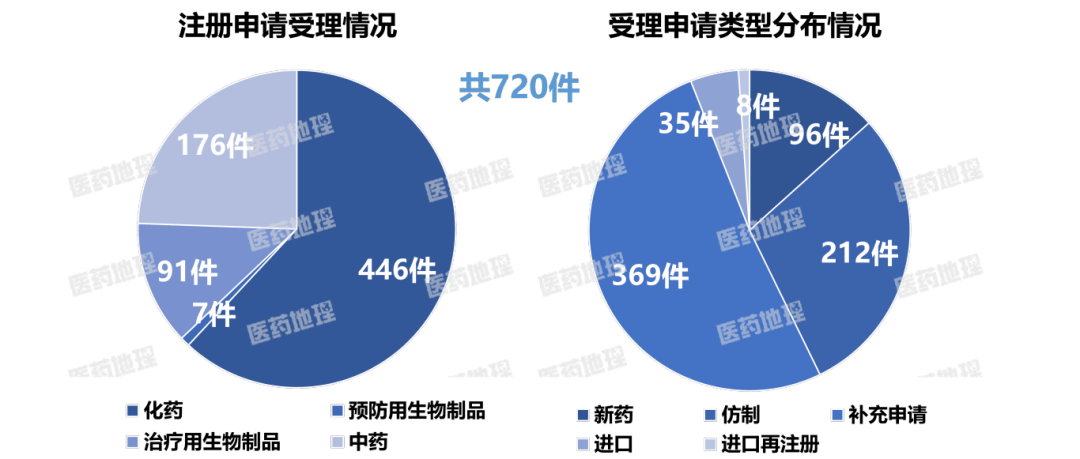
2025年4月上半月,国家药品监督管理局药品审评中心(CDE)共受理新注册申请720件(按受理号计,一次性进口申请除外),具体情况如下图。
统计申报临床的药品数量,CDE新受理临床申请114件(按受理号计),其中国产药92件、进口药22件。
统计申请上市的药品数量,CDE新受理生产/上市注册申请共229件(按受理号计),其中国产药216件,进口药13件。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品批准概况
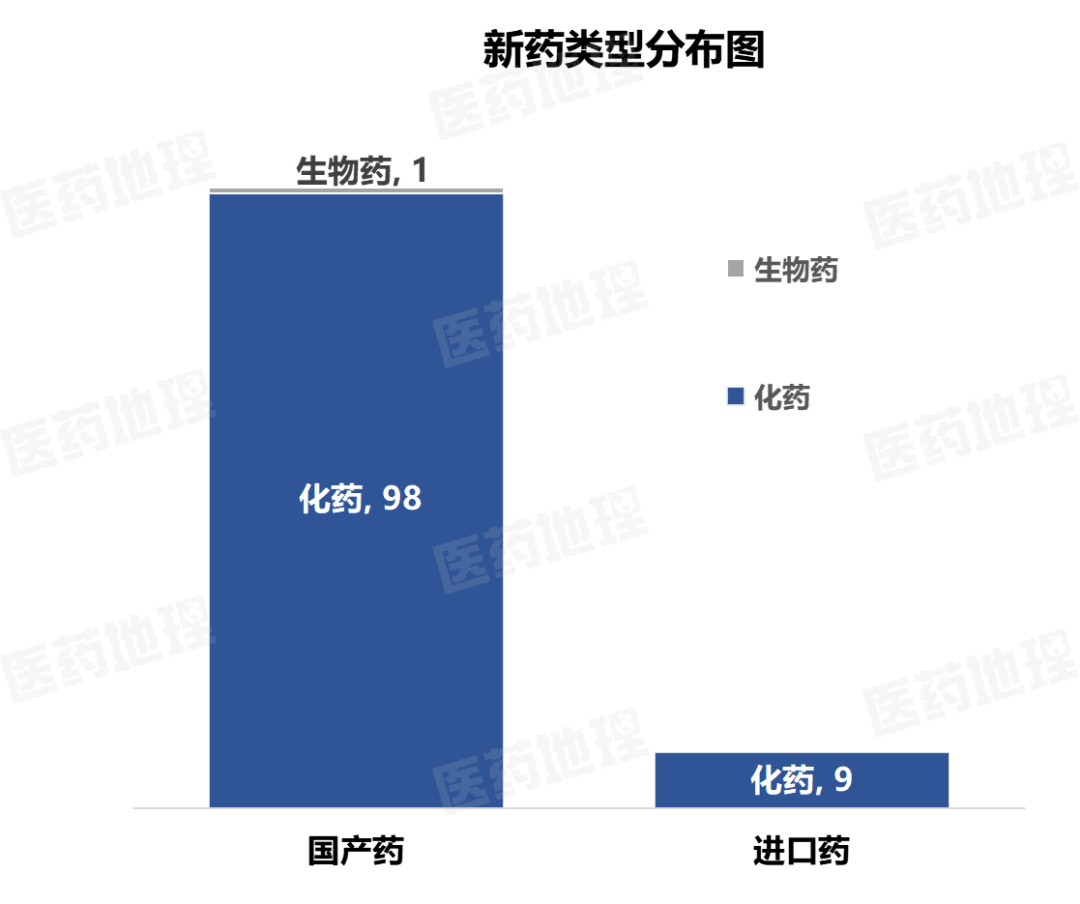
2025年4月上半月,国家药品监督管理局(NMPA)共批准药品上市申请150件。其中,国产药品135件,进口药品15件。
国产药涉及 99个品种,其中包括98个化药,1个生物制品。
进口药涉及 9个品种,均为化药。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心