2025年版第7期《全球药研新动态》
新鲜出炉!

全球新药批准概况
2025年4月下半月,美国食品药品监督管理局(FDA)批准新药申请(NDA)3个,其中包括1个新生物制品。欧洲药品管理局(EMA)、日本医药品医疗器械综合机构(PMDA)均未有批准新药。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
全球药品研发概况
2025年4月下半月,全球进入注册前阶段的新药有1个。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品注册申报概况
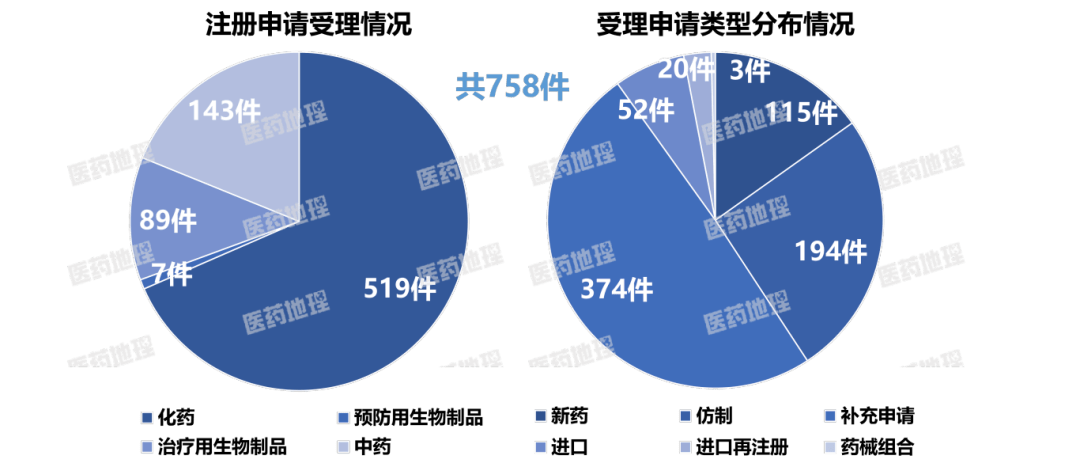
2025年4月下半月,国家药品监督管理局药品审评中心(CDE)共受理新注册申请758件(按受理号计,一次性进口申请除外),具体情况如下图。
统计申报临床的药品数量,CDE新受理临床申请131件(按受理号计),其中国产药101件、进口药30件。
统计申请上市的药品数量,CDE新受理生产/上市注册申请共230件(按受理号计),其中国产药208件、进口药22件。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品批准概况
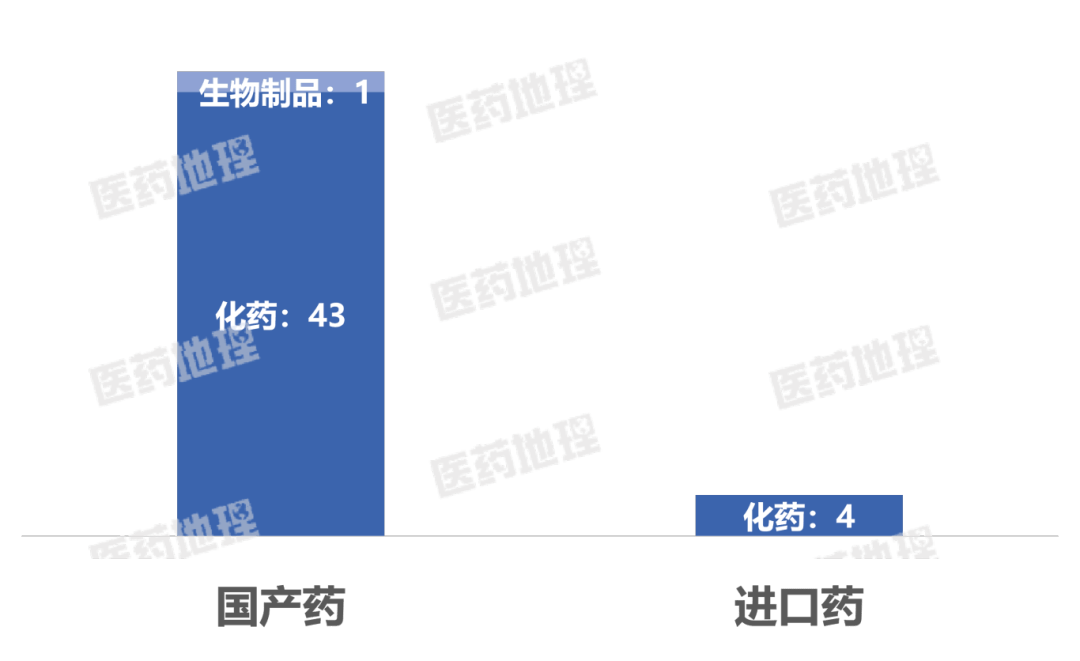
2025年4月下半月,国家药品监督管理局(NMPA)共批准药品上市申请68件。其中,国产药品62件,进口药品6件。
国产药涉及44个品种,其中包括43个化药、1个生物制品。
进口药涉及4个品种,其中包括4个化药。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心





