免疫检查点抑制剂(ICIs)可通过程序性死亡受体-1(PD-1)、程序性死亡受体配体1(PD-L1)、靶向细胞毒性T淋巴细胞相关抗原-4(CTLA-4)和淋巴细胞激活基因-3(LAG-3)重塑多种恶性肿瘤的治疗格局。
然而,此种非特异性免疫系统在强化抗肿瘤免疫的同时,也可能破坏机体免疫耐受平衡,引发一系列免疫相关不良事件(irAEs),如垂体炎、心肌炎、肺炎和结肠炎等。此外,ICIs还可引起关节炎、类风湿关节炎、肌炎、肌痛等特定风湿病样症状,称为风湿性irAEs[1]。
值得注意的是,风湿性irAEs的临床表现常呈慢性、非特异性,因此在真实世界中的发生率可能高于临床试验报道的数据[2]。目前,其发病机制尚未完全阐明。研究显示,ICIs可通过阻断T细胞表面的抑制受体激活T细胞,并诱导其针对恶性细胞的免疫反应[3]。该过程导致外周免疫耐受被破坏,自身反应性CD4+T细胞及CD8+T细胞被激活,进而浸润并攻击关节滑膜、肌肉等组织,并释放大量促炎细胞因子[如干扰素-γ、肿瘤坏死因子-α、白细胞介素-6、白细胞介素-17],形成类似于传统免疫介导的风湿性疾病(IMRD)炎症微环境,最终导致组织损伤。
研究表明,尽管ICIs引起的风湿性irAEs与IMRD在症状上具有相似性,但在临床表现和免疫学机制方面存在差异。然而,目前国内外对风湿性irAEs的处理多借鉴IMRD的治疗策略[4],缺乏针对其独特机制的干预手段。本研究基于美国食品药品监督管理局不良事件报告系统(FAERS)数据,探讨真实世界中ICIs与风湿性irAEs风险的关联,并观察风湿性irAEs在患者人群中的分布特征及临床结局,以期为临床实践中风湿性irAEs的早期识别、精准干预和全程管理提供循证依据和参考。
1 资料与方法
1.1 数据来源
本研究将已上市ICIs作为目标药物。通过DrugBank数据库检索,共纳入13种被明确定义为ICIs的药物,包括PD-1抑制剂、PD-L1抑制剂、CTLA-4抑制剂以及LAG-3抑制剂,具体见表1。
表1 ICIs药物种类及上市时间

1.2 数据检索
利用FAERS数据库中2011年1月1日—2025年3月31日的数据进行回顾性研究。初步检索获得相关报告,当报告 ID和FDA日期相同时选择最新FDA日期并删除其他重复记录,进一步筛选得到与风湿性irAEs相关的有效报告2643份,数据检索流程见图1。
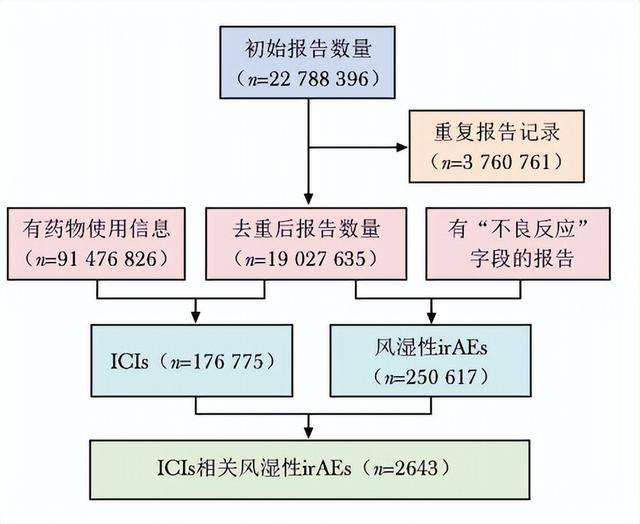
图1 数据检索流程图
irAEs:免疫相关不良事件;ICIs:同表1
1.3 药物和不良事件的数据映射
根据《国际医学用语词典》(MedDRA) 第27.1版中的首选术语 (PT),对目标药物相关不良事件进行编码。参照文献[5]选取MedDRA中与风湿性irAEs相关的10个PT作为本研究重点分析对象(表2)。
表2 MedDRA中与风湿性irAEs相关的PT

1.4 统计学处理
本研究所有数据处理和统计分析均采用SAS 9.4软件进行分析。采用药物警戒研究中常用的不成比例分析法用于检测自发性信号[6]。采用频率法和贝叶斯法,通过报告比值比(ROR)、比例报告比 (PRR)、贝叶斯置信传播神经网络(BCPNN)和经验贝叶斯几何平均值(EBGM)评估ICIs与风湿性irAEs的潜在关联。具体记录四种算法的计算公式和信号检测标准见表3。
表3 ICIs与风湿性irAEs关联性评估的计算公式和信号检测标准[7]

2 结果
2.1基本信息
在22 788 396份涉及13种与ICIs相关的不良事件报告中,通过PT筛选出250 617份风湿性irAEs相关报告,其中与ICIs直接相关的风湿性irAEs报告2643份。
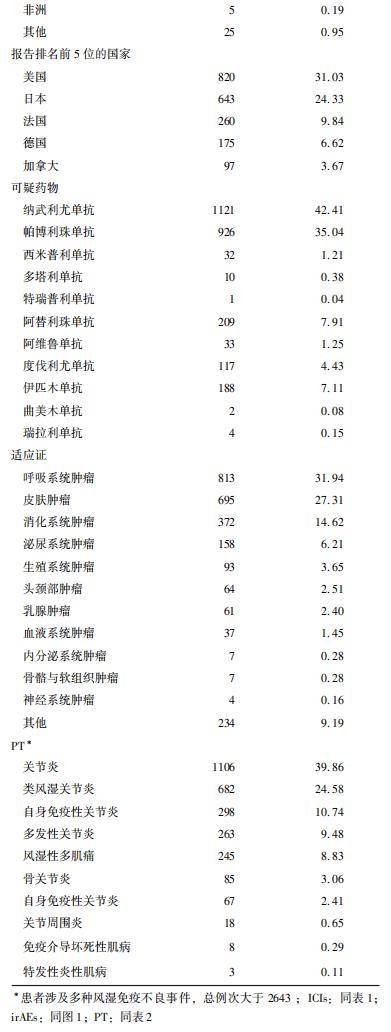
数据显示,发生风湿性irAEs的男性患者占比高于女性患者,以45~74岁年龄段最为常见(49.80%,1316/2643),报告主体以医师(47.26%,1249/2643)和患者(19.11%,505/2643)居多;在地区分布上,排名前3位的地区分别为北美洲(35.11%,928/2643)、欧洲(31.93%,844/2643)和亚洲(27.09%,716/2643);报告最多的国家为美国(31.03%,820/2643),其次为日本(24.33%,643/2643);出现风湿性irAEs最多的药物为纳武利尤单抗(42.41%,1121/2643),其次为帕博利珠单抗(35.04%,926/2643);2643例出现风湿性irAEs的患者中,2545例有明确疾病诊断,适应证以呼吸系统肿瘤(31.94%,813/2545)、皮肤肿瘤(27.31%,695/2545)、消化系统肿瘤(14.62%,372/2545)以及生殖系统肿瘤(6.21%,158/2545)为主;在风湿性irAEs分布上,以各类型关节炎为主,也包括风湿性多肌痛(8.83%,245/2775)、免疫介导坏死性肌病(0.29%,8/2775)以及特发性炎性肌病(0.11%,3/2775)等,ICIs相关风湿性irAEs报告基本情况详见表4。
表4 ICIs相关风湿性irAEs报告基本情况

在时间分布上,2019年、2021年、2023年及2024年报告人数均超过300例,年报告例数见图2。
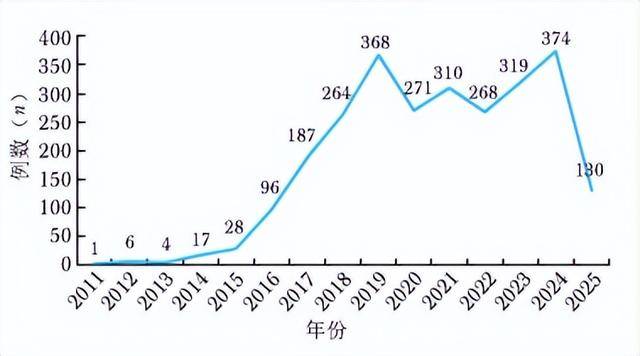
图2 ICIs相关风湿性irAEs年报告例数
ICIs:同表1;irAEs:同图1
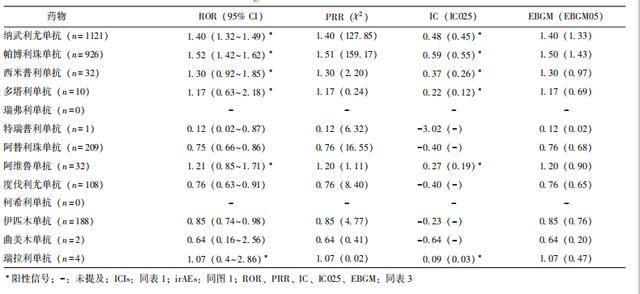
2.2信号检测结果
采用4种信号检测方法对数据进行深度分析。结果显示,ROR 法与IC 法检测所得阳性信号药品的检验结果一致。纳武利尤单抗、帕博利珠单抗、西米普利单抗、多塔利单抗、阿维鲁单抗以及瑞拉利单抗这6种ICIs在治疗风湿性 irAEs方面均获得2个阳性信号。13种ICIs相关风湿性irAEs不良事件信号检测结果见表5。
表5 ICIs相关风湿性irAEs信号检测结果
2.3 发病时间和不良事件后果
出现ICIs相关风湿性irAEs的平均时间为125.82 d,其中纳武利尤单抗平均发生时间为132.18 d,帕博利珠单抗为133.22 d,西米普利单抗为370.50 d,多塔利单抗为191.83 d,特瑞普利单抗为752.00 d,阿替利珠单抗为125.09 d,阿维鲁单抗为175.21 d,度伐利尤单抗为57.83 d,伊匹木单抗为70.18 d,瑞拉利单抗为16.50 d。
Kruskal-Wallis检测结果显示,不同ICIs出现风湿性irAEs的平均时间差异具有统计学意义(P=0.004)。进一步两两比较,Dunn's多重比较检验显示,差异无统计学意义(P>0.05)。irAEs的发作时间呈现明显早期集中趋势,见图3。
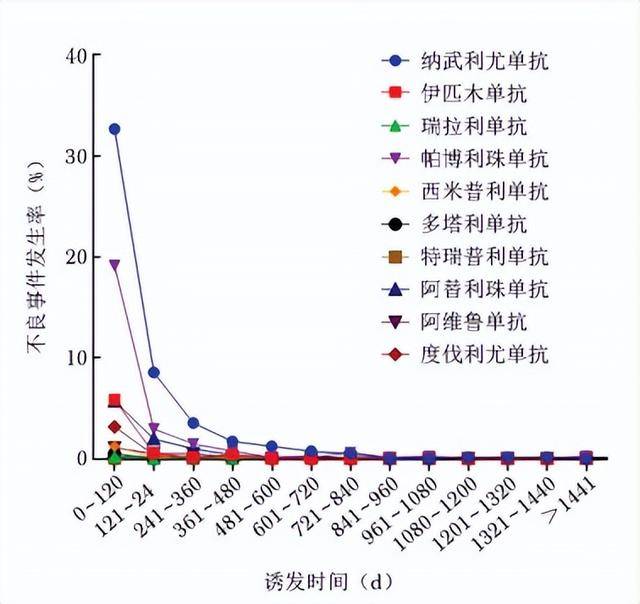
图3 ICIs相关风湿性irAEs临床结局分布
ICIs:同表1;irAEs:同图1
在不良事件发生时间明确的819份报告中,69.72%(571/819)的不良事件发生于用药后120 d内(早期高风险期),121~240 d是第2个高风险期(14.90%,122/819),241~360 d是第3高风险期(6.84%,56/819)。其中,使用纳武利尤单抗 0~120 d报告发生不良事件268例(32.72%,268/819),帕博利珠单抗报告157例(19.17%,157/819)。可能由于瑞弗利单抗和柯希利单抗上市时间较短,未报告相关不良事件。
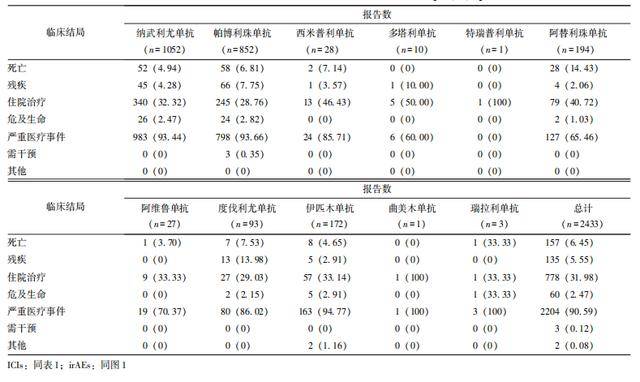
在有明确不良事件结局记录的2433份报告中, 6.45%(157/2433)的患者死亡,5.55%(135/2433)发生残疾,2.47%(60/2433)出现危及生命情况,31.98%(778/2433)需住院治疗,90.59%(2204/2433)为其他严重医疗事件,详见表6。
表6 ICIs相关风湿性irAEs的临床结局[n(%)]
3 讨论
自身免疫力随年龄增长而下降,这一过程与体内炎症细胞因子水平升高及T细胞多样性下降有关[8]。本研究发现,风湿性irAEs的报告年龄集中于45~74岁,但这一发现与部分研究结论存在差异。有报道显示,年龄并非接受ICIs单药治疗患者发生不良事件的独立影响因素,老年患者对ICIs的耐受性似乎与年轻患者相当[9-10]。研究的差异性说明45~74岁发生癌症的风险较高,因此,使用ICIs的人数较多。然而年龄在ICIs相关风湿性irAEs中的确切作用仍需深入研究,可能与癌症种类、ICIs类型以及联合用药等多种复杂因素有关。
本研究irAEs报告病例以男性居多,说明其发生可能存在性别差异,与多项研究结果相符[11-13]。然而,有研究认为,女性是irAEs的独立危险因素,对多种自身免疫性疾病具有更高的易感性[14-15]。这一研究结论可能与回顾性药物警戒数据库分析存在的内在特征和固有局限性相关,极有可能仅反映了接受ICIs治疗的总体人群中男性患者占比较大的现实。
本研究亦揭示了风湿性irAEs发病时间的宽幅特征。尽管大部分不良事件发生于用药后120 d内,与既往研究报道的中位发病时间基本吻合[12-13],但其发生窗口可从首次用药后数周延伸至停药后数年[16]。这种较大的时间跨度可能反映不同免疫学触发机制。早期发生的不良事件可能与患者体内预存、处于亚临床状态的自身反应性T细胞克隆被迅速激活有关[17],而晚期不良事件则可能涉及更为复杂的“抗原扩散”过程,即初始抗肿瘤免疫反应破坏肿瘤细胞后释放新的自身抗原,从而逐步诱发针对新抗原的二次免疫攻击[18]。这种发病的不可预测性对临床医生提出了更严峻的挑战,要求在ICIs治疗全程乃至停药后相当长一段时间内,需对风湿免疫相关症状保持高度警惕。
本研究从大规模数据中验证了ICIs与一系列风湿性irAEs(如关节炎、类风湿关节炎、肌炎、肌痛等)之间存在信号关联,具有重要的临床价值。值得注意的是,作为一项基于自发上报系统数据库的研究,本研究无法计算精确的不良事件发生率,但揭示的报告频率特征可与基于临床试验的流行病学数据进行对比和互补。
除瑞弗利单抗外,其他 PD-1 抑制剂均检出信号,与报道中提及最多的ICIs为抗 PD-1 类药物相契合[19]。其中,纳武利尤单抗和帕博利珠单抗报告频次较高,这一结果与其全球广泛临床应用及研究热点地位一致;而柯希利单抗可能因上市时间较短,在本研究中未探测出信号。
本研究结果显示,呼吸系统肿瘤、皮肤黑色素瘤、消化系统肿瘤及泌尿生殖系统肿瘤的信号贡献度较高,与既往文献结论一致[20]。这一结果可反映ICIs相关风湿性irAEs的主要适应证,表明其发生可能与肿瘤抗原表达谱、人类白细胞抗原(HLA)遗传背景及宿主基线免疫状态有关[21],提示在不同肿瘤类型中开展风险分层管理的必要性。
此外,在临床结局方面,报告中6.45%(157/2433)的患者死亡,31.98%(778/2433)需住院治疗。一项调查启动ICIs治疗后出现类风湿关节炎患者的死亡率研究结果发现,大多数症状轻微且经治疗均可控制,并不预示死亡率更高[22]。研究提示,发生风湿性irAEs的患者具有更佳的肿瘤治疗应答[23]和癌症临床结局[2],表明驱动irAEs和抗肿瘤效应的免疫通路可能存在重叠,为探索疗效预测标志物提供了新思路。
本研究基于真实世界数据库,纳入的样本量超过单一临床试验,有助于识别罕见严重不良事件,并描绘真实临床风险谱。然而,本研究仍存在一定局限性:首先,可能存在部分报告偏倚[24](如新药或关注度高的药物更易被上报)和部分信息缺失问题;其次,FAERS数据库缺乏关键临床资料,如患者既往自身免疫疾病史,限制了危险因素分层分析;最后,信号挖掘研究仅能提示关联性,无法证实因果关系。
综上所述,本研究证实,ICIs与多种风湿性irAEs存在关联,临床应用ICIs时应常规监测风湿免疫相关症状,并关注特定药物及发病时间等高风险特征。未来需开展大规模、多中心、前瞻性队列研究,以明确不同ICIs药物及癌症类型患者中风湿性irAEs的真实发生率、量化危险因素及长期预后。此外,应积极探索预测风湿性irAEs发生的生物标志物[1,25](如自身抗体、HLA、抗核抗体、外周血免疫细胞亚群等),以实现高危患者早期预警和个体化管理,保障抗肿瘤疗效的同时,最大限度降低irAEs发生风险,从而提升肿瘤患者整体生存获益。