绿茶Camellia sinensis(L.)Kuntze为山茶科、山茶属植物,性凉,味苦辛甘,归肝、心包、心、肺、脾、肾、胃经,具有下气消食、清利头目、清降痰浊、清热解毒的功效[1]。现代药理研究表明,绿茶中含有丰富的茶多酚类化合物,具有极佳的抗炎、抗氧化、促血管生成等作用,其中以表没食子儿茶素没食子酸酯(EGCG)为代表的多种儿茶素类成分为其潜在药效物质群[2-3]。眼部相关疾病多与眼内炎症、氧化应激、细胞凋亡有关,茶多酚类物质已被应用于多种眼部疾病的药物开发研究[4-6]。基于此,课题组前期围绕绿茶干预年龄相关性黄斑变性(AMD)的药效机制开展了系列研究,发现绿茶提取物能够显著抑制强光刺激及强氧化剂导致的AMD大鼠视网膜炎症、氧化应激损伤及细胞凋亡水平[7-8]。
AMD作为一种与年龄高度相关的退行性疾病,在老年人群中发病率较高,可损伤中心视力,严重影响老年人生活质量[9]。中医证候中,AMD多归为“痰瘀”“血滞”“气虚”范畴,因此临床以疏肝补肾类药物配伍治疗[10-11]。临床上,AMD分为干性AMD(dAMD)和湿性AMD(wAMD),wAMD主要表现为脉络膜血管过度异常生长及视网膜出血[9]。课题组前期研究中证实,绿茶具有干预AMD的功效,能够有效抑制氯化钴诱导的斑马鱼眼底血管异常增生;同时,谱-效相关研究中发现奎尼酸、表儿茶素(EC)、没食子儿茶素(GC)、表没食子儿茶素(EGC)、没食子儿茶素没食子酸酯(GCG)和EGCG是绿茶干预AMD的关键药效组分[8],但目前尚未完成有效组分优势配伍结构的筛选,且其配伍后的药效活性及作用机制尚不十分明确。
中药配伍规律是中医辨证论治理论的具体体现。随着化学成分分离技术的发展,其研究已不再限于多药味间的组合配伍。张伯礼院士[12]提出以组分配伍研制现代中药的新策略,即开展有效组分配伍研究。随着该研究的深入,贾晓斌教授[13]进一步提出“组分结构”理论,认为中药药效物质基础由多个组分按照特定的组成结构(含量)比例构成,并系统构建了以组分为功能单位的中药研究新模式。
鉴于此,本研究以组分结构理论为指导,采用均匀设计法考察绿茶有效组分在不同配伍结构下的药效作用,解析各组分间的协同作用及配伍规律;同时结合网络药理学及分子对接技术,预测有效组分干预AMD的潜在作用机制,并通过实时荧光定量PCR(qRT-PCR)技术验证有效组分最佳配伍结构对AMD斑马鱼眼组织关键靶点表达的影响,旨在为绿茶组分中药的研发及AMD临床治疗新策略提供关键数据支撑。
1材料
1.1仪器
BP211D型电子分析天平,德国赛多利斯科学仪器有限公司;Allegra X-30R高速冷冻离心机,美国贝克曼库尔特有限公司;IX73荧光显微镜,日本Olympus公司;BJPX-L200光照培养箱,山东博科控股有限公司;KZ-III-F组织研磨仪,武汉塞维尔生物科技有限公司;Roche LightCycler 96 qRT-PCR,瑞士Roche公司;Invitrogen Qubit 4超微量分光光度计,美国Thermo Scientific公司;Z-A-D5斑马鱼养殖系统,上海海圣生物实验设备有限公司。
1.2药物与试剂
1.3动物
成年Fli1a:EGFP血管荧光转基因斑马鱼由山东中医药大学药物研究院提供,培养于专业斑马鱼养殖系统,培养环境维持恒温28 ℃,每日14 h/10 h光/暗循环。成年雌雄斑马鱼在交配缸中自然交配产卵后,收集至培养皿中,于28 ℃恒温光照培养箱中孵育。
2方法
2.1实验用药品溶液的制备
精密称取奎尼酸、EC、GC、EGC、GCG、EGCG各10.00 mg置于6个量瓶中,纯水定容至刻度线,制备成2 mg·mL−1的母液,4 ℃保存备用;选择氯化钴作为AMD斑马鱼造模药物,精密称取10.00mg氯化钴置于量瓶中,纯水定容至刻度线,制备成2 mg·mL−1的母液,4 ℃保存备用,后续实验时稀释至100 µg·mL−1;选择七叶洋地黄双苷滴眼液作为阳性药物,用纯水稀释至20 µg·mL−1(以七叶亭苷计算)。
2.2绿茶有效组分对斑马鱼存活率的影响
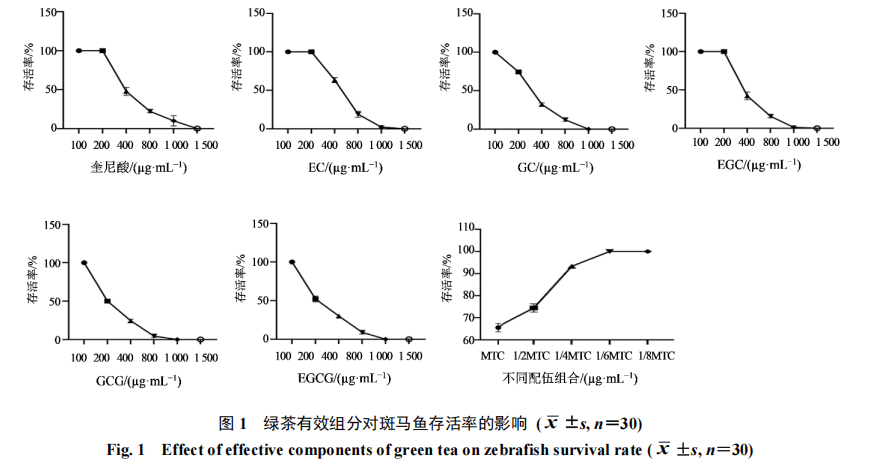
选择2 dpf的斑马鱼,脱膜后在荧光显微镜下筛选发育正常的幼鱼于6孔板中,每孔30尾,每组2个复孔。分别考察不同质量浓度(100、200、400、800、1 000、1 500 µg·mL−1)奎尼酸、EC、GC、EGC、GCG、EGCG干预72 h对斑马鱼存活率的影响,确定斑马鱼对各组分的最大耐受浓度(MTC)。随后将各组分分别按照MTC、1/2MTC、1/4MTC、1/6MTC、1/8MTC进行组合,考察药物组合对斑马鱼存活率的影响。
2.3AMD斑马鱼模型的建立
选择2 dpf的斑马鱼,脱膜后在荧光显微镜下筛选发育正常的幼鱼于6孔板中。选择100 µg·mL−1氯化钴干预72 h致斑马鱼眼内缺氧诱导眼底血管异常生长,构建渗出型AMD斑马鱼模型[8],在荧光显微镜下观察斑马鱼眼底血管生长情况,利用Image J软件测量斑马鱼眼底血管荧光面积,评价AMD斑马鱼造模是否成功。
2.4绿茶有效组分配伍结构研究
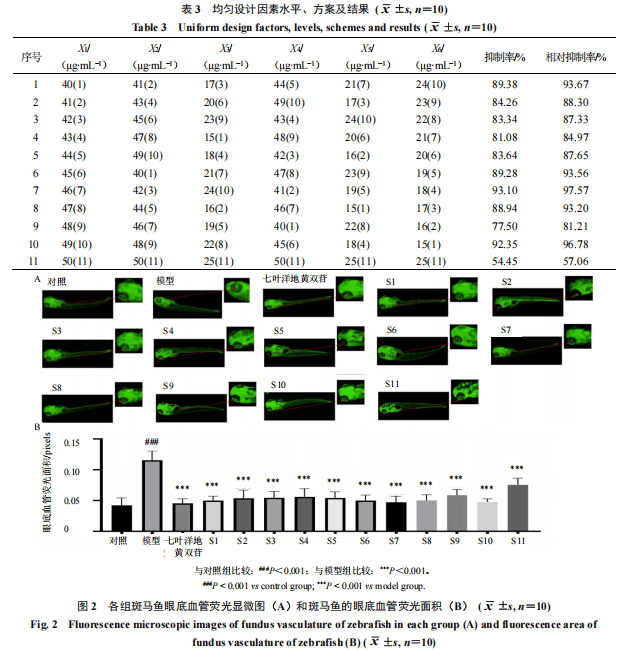
2.4.1均匀设计分组将奎尼酸(X1)、EC(X2)、GC(X3)、EGC(X4)、GCG(X5)、EGCG(X6)作为考察因素,各设11个水平,剂量范围根据“2.2”项确定的各组分MTC设定。采用U11(116)均匀设计表(表1)对绿茶有效组分的最佳配伍结构进行筛选,根据均匀设计使用表,当考察因素数为6时,偏差为0.494 2,选择1~6列进行实验。
2.4.2最佳组分配伍结构考察选择2 dpf的斑马鱼于6孔板中,每孔10尾。设置对照组、模型组、阳性药(20 µg·mL−1七叶洋地黄双苷滴眼液)组和11个绿茶有效组分[S1~S11,给药剂量按照均匀设计表U11(116)确定]组。除对照组外,其余各组均按“2.3”项下方法造模,阳性药组与S1~S11组在造模同期给药。28 ℃孵育72 h,观察斑马鱼存活情况,并在荧光显微镜下观察斑马鱼眼底血管生长情况,利用Image J软件测量斑马鱼眼底血管荧光面积(A),计算各组斑马鱼眼底血管异常生长的抑制率及相对抑制率。
抑制率=(A模型-A给药)/(A模型-A对照)
相对抑制率=绿茶有效组分抑制率/阳性药抑制率
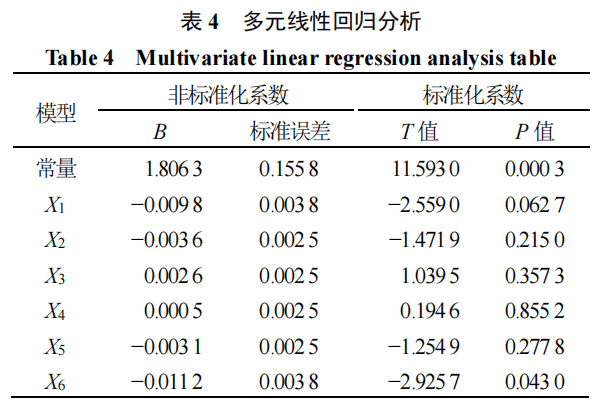
采用SPSS 23.0软件,以X1、X2、X3、X4、X5、X6为自变量,以斑马鱼眼底血管异常生长的相对抑制率为因变量(Y),进行多元线性回归分析,确定绿茶有效组分的最佳配伍结构。
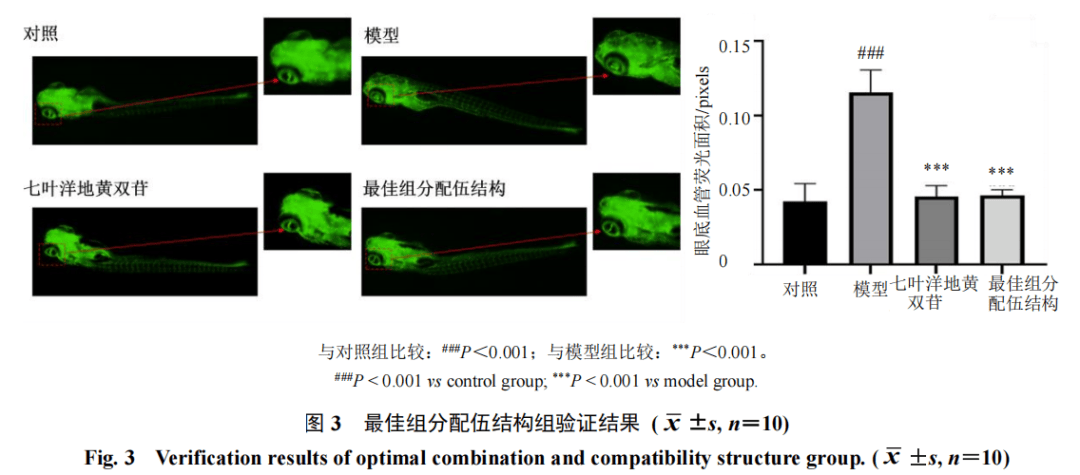
2.4.3验证实验选择2 dpf斑马鱼于6孔板中。设置对照组、模型组、阳性药(20 µg·mL−1七叶洋地黄双苷滴眼液[8])组和绿茶有效组分最佳配伍组。除对照组外,其余各组均按“2.3”项下方法造模,阳性药组与最佳配伍组在造模同期给药,给药干预后在荧光显微镜下拍照,考察绿茶有效组分的最佳配伍结构对斑马鱼眼底血管异常生长的影响。
2.5网络药理学
2.5.1 绿茶有效组分干预AMD的靶点筛选在Swiss target prediction和Pharmmapper数据库中检索奎尼酸、EC、GC、EGC、GCG、EGCG的靶点,去重合并即得各成分的作用靶点。以“age-related macular degeneration”为关键词在CTD、GeneCards数据库中进行检索,并以“relevance score”大于中位数,“inference score”大于中位数进行二次筛选,去重整合,获得AMD疾病靶点。将各成分的作用靶点与AMD疾病靶点取交集,即为绿茶有效组分干预AMD的靶点。
2.5.2 蛋白质-蛋白质相互作用(PPI)网络的构建及核心靶点的筛选将筛选出的作用靶点导入STRING数据库,种属选择“Homo sapiens”,最小互相作用阈值设定为“highest confidence”,并隐藏游离的节点。运用CytoScape 3.9.1构建绿茶有效组分-AMD“活性成分-靶点”图及PPI网络图,并利用内置Network Analyzer分析成分及作用靶点的网络拓扑参数,并以节点度值(degree)为标准筛选核心靶点。
2.5.3 基因本体(GO)功能注释和京都基因与基因组百科全书(KEGG)信号通路富集分析将筛选出的绿茶有效组分干预AMD的核心靶点在DAVID数据库中进行GO富集分析和KEGG信号通路分析,预测关键作用通路及靶点。
2.5.4分子对接利用PubChem数据库下载各成分的sdf结构文件,导入ChemBio 3D软件调整化合物的空间构象,进行minimize能量优化,保存为mol2格式。随后从PDB网站中下载关键作用靶点的3D结构,应用PyMOL去除水分子和原始配体。最后利用Maestro软件对各成分与关键作用靶点进行对接。
2.6qTR-PCR实验验证
体式显微镜下切割“2.4.3”项实验结束后的斑马鱼眼睛,并进行整体匀浆,利用RNA提取试剂盒提取斑马鱼眼组织总RNA,利用qPCR仪将RNA逆转录成cDNA,进行PCR扩增,扩增条件为:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸10 s,40个循环。引物由生工生物工程(上海)股份有限公司合成,以β-actin为内参基因,引物序列见表2。

2.7数据分析
数据均以
表示,采用SPSS 23.0软件进行统计学分析,用GraphPad Prism7进行统计结果图形分析,两组间比较采用单因素ANOVA检验方法,P<0.05表示差异有统计学意义。
3结果
3.1绿茶有效组分对斑马鱼存活率的影响
由图1可知,当奎尼酸、EC、EGC质量浓度高于200µg·mL−1时,GC、GCG、EGCG质量浓度高于100µg·mL−1时,斑马鱼开始出现死亡,且随药物质量浓度升高死亡数量逐渐增加。因此奎尼酸、EC、EGC的MTC为200 µg·mL−1,GC、GCG、EGCG的MTC为100 µg·mL−1。为后续比较S1~S11对AMD斑马鱼的药效作用,需先考察以各组分的MTC、1/2 MTC、1/4 MTC、1/6 MTC、1/8 MTC组合给药时对斑马鱼存活率的影响,结果表明,当S1~S11以1/4 MTC组合给药时,斑马鱼开始出现死亡现象,但死亡数量较少,当高于此质量浓度时,出现大量死亡。因此最终确定奎尼酸、EC、GC、EGC、GCG、EGCG的最大给药质量浓度分别为50、50、25、50、25、25 µg·mL−1,并以此质量浓度为上限进行均匀设计实验。
3.2最佳组分配伍结构考察结果
基于表1及“3.1”项确定的最大给药质量浓度,共设计11个绿茶有效组分配伍组合,开展干预AMD斑马鱼的药效实验,因素、水平方案及结果见表3。各组药效结果见图2。与对照组相比,模型组斑马鱼眼底血管荧光面积显著增大(P<0.001);与模型组相比,阳性药组及S1~S11斑马鱼眼底血管荧光面积显著减小(P<0.001),且均逐渐趋近于对照组,其中S11干预效果最差,但相较于模型组仍然具有显著性差异(P<0.001),S7组干预效果最为明显,眼底血管异常生长的抑制率及相对抑制率最高,为最优药效组,此时有效组分配伍结构为X1∶X2∶X3∶X4∶X5∶X6=46∶42∶24∶41∶19∶18。
多元线性回归分析结果见表4。分析显示,所建立的多元线性回归方程为Y=1.806 34-0.009 8 X1-0.003 6 X2+0.002 56 X3+0.000 48 X4-0.003 1 X5-0.011 2 X6,其中Y代表相对抑制率。该方程的决定系数R²=0.954 87,表明模型对数据的拟合程度较高;且P值为0.041 39,说明回归方程具有统计学意义。由于相对抑制率越大,对应药效越佳,因此通过求解该回归方程中Y的最大值,可确定最佳组分配伍结构。最终经模型预测,最佳组分配伍比例为X1∶X2∶X3∶X4∶X5∶X6=8∶8∶5∶10∶3∶3。
由图3可知,与模型组相比,最佳组分配伍结构组斑马鱼眼底血管荧光面积显著减小(P<0.001),趋近阳性药组,抑制率和相对抑制率为94.23%和98.75%,且与S7组相比药效更好。因此证实绿茶有效组分干预AMD的最佳配伍结构为X1∶X2∶X3∶X4∶X5∶X6=8∶8∶5∶10∶3∶3。
3.3网络药理学分析结果
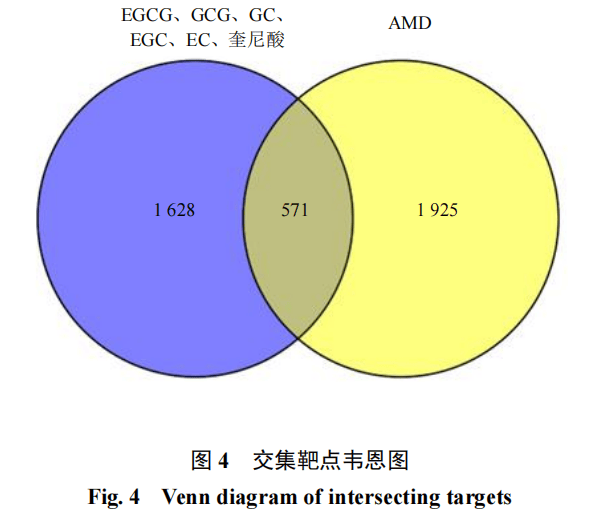
3.3.1潜在靶点筛选通过检索数据库,对奎尼酸、EC、GC、EGC、GCG、EGCG进行作用靶点筛选,整合去重后共获得2 199个潜在靶点。以“age-related macular degeneration”为关键词,在数据库中检索疾病靶点,整合去重后共筛选出2 496个作用靶点。利用Venny 2.1将药物靶点与疾病靶点取交集并绘制韦恩图,共计得到571个共同靶点,见图4。
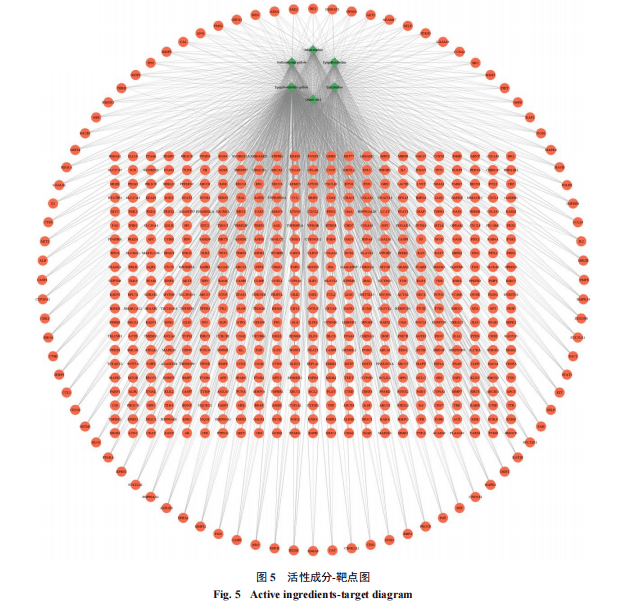
3.3.2 “活性成分-靶点”网络图及PPI网络图的构建将6个绿茶有效组分靶点与AMD疾病交集靶点联合构建“活性成分-作用靶点”网络,该网络共有577个节点,1 318条边(图5)。成分与靶点之间连线越多则度值越大,表明成分与药效间的关联性越强,在6个组分中,度值由大到小依次为EGCG、GCG、GC、EGC、EC、奎尼酸。
采用String数据库对绿茶有效组分干预AMD的571个靶点进行蛋白交互分析,并利用Cytoscape 3.9.1进行拓扑分析筛选核心靶点,构建核心靶点PPI网络图,见图6。结果显示,该网络共涉及84个节点,2 942条边,平均度值为70.048,根据节点度值排名筛选出9个并列第1位次(度值=83)的靶点,分别为肿瘤蛋白53(TP53)、肿瘤坏死因子受体(TNF)、白细胞介素6受体(IL6)、信号转导和转录激活因子3(STAT3)、缺氧诱导因子1α(HIF1A)、MYC原癌基因(MYC)、编码β-连环蛋白(CTNNB1)、JUN原癌基因(JUN)、表皮生长因子受体(EGFR),预测其为绿茶有效组分干预AMD的核心靶点。
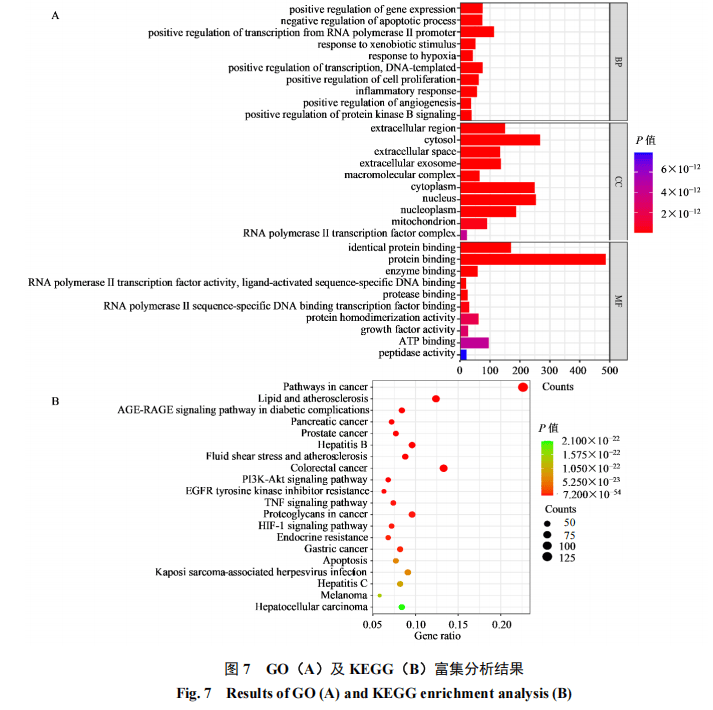
3.3.3 GO和KEGG富集分析将筛选出的绿茶有效组分干预AMD的核心靶点进行GO和KEGG富集分析。通过GO功能富集分析,根据P值排序,分别筛选前10个分析条目,见图7-A。在生物过程(BP)分类中,与AMD相关的条目主要涉及凋亡过程的负调控、缺氧反应、细胞增殖的正向调控、炎症反应和正调控血管生成;在细胞组成(CC)分类中,与AMD相关的条目主要涉及细胞外外泌体、大分子复合物、线粒体、RNA聚合酶II转录因子复合物;在分子功能(MF)分类中,与AMD相关的条目主要涉及RNA聚合酶II转录因子活性、配体激活序列特异性DNA结合、生长因子活性、肽酶活性。
通过KEGG富集分析,在P<0.05时,6个绿茶有效组分共富集到179条信号通路,筛选出前20条通路并制成气泡图展示,见图7-B。结果显示,排名前3的通路为癌症的发病途径、脂质与动脉粥样硬化、糖尿病并发症中的AGE-RAGE信号通路,可见6个组分也可能具有抗肿瘤和干预糖脂代谢紊乱的药效作用;在排名前20的信号通路中,PI3K-Akt信号通路、TNF信号通路、Apoptosis和HIF-1缺氧信号通路与AMD疾病发生发展高度相关,通路中涉及的关键作用靶点为磷脂酰肌醇3激酶(PI3K)、蛋白激酶B(Akt)、TNF、B细胞淋巴瘤/白血病-2基因(BCL-2)、BCL2相关X蛋白(BAX)、HIF1A和血管内皮生长因子α(VEGFA),由此可见6个绿茶有效组分可能通过影响这些信号通路进程,调控关键靶点表达,发挥治疗AMD的作用。
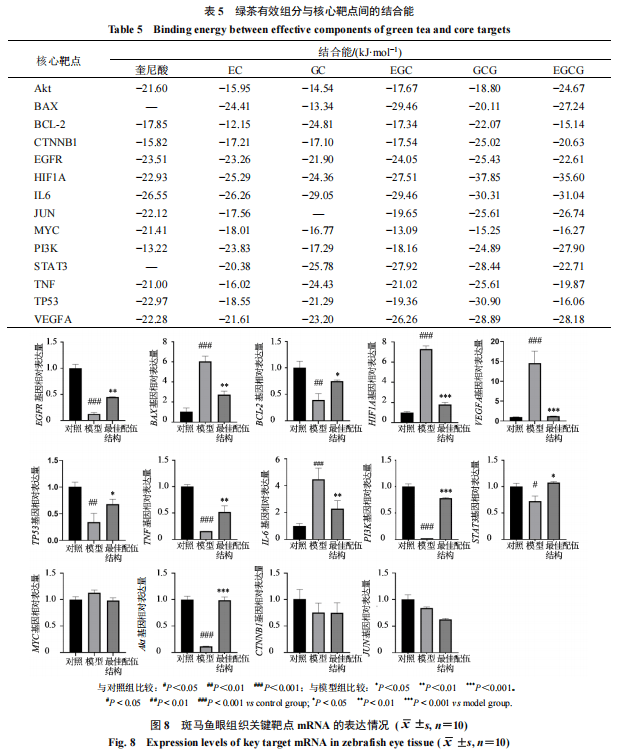
3.3.4分子对接验证分子对接实验中,分子与靶点彼此结合能越低,配体和受体蛋白之间的结合就会越稳定,当结合能小于−20.92 kJ·mol−1时,两者具有较强的结合活性;当结合能小于−29.29 kJ·mol−1时,两者具有强烈的结合活性。将上述PPI网络中筛选出的核心靶点以及KEGG富集分析结果中筛选出的PI3K-Akt、HIF-1、Apoptosis关键信号通路中的核心靶点,整合去重后共计14个核心靶点与EGCG、GCG、GC、EGC、EC、奎尼酸进行分子对接实验,具体对接结果及结合能信息见表5。结果显示,6个成分与14个靶点之间表现出较好的结合能力,且多数结合能小于−20.92 kJ·mol−1,表明成分与靶点之间的对接活性较好。其中GCG与CTNNB1、EGFR、HIF1A、STAT3、TNF、TP53、VEGFA靶点的对接活性最好,EGCG与Akt、IL6、JUN、PI3K靶点BCL-2、BAX靶点的对接活性最好。并且在14个靶点中,HIF1A、EGFR、IL6、VEGFA靶点与6个成分之间的结合能均小于−20.92 kJ·mol−1,表明各成分与靶点间均存在较强的结合活性,可能通过调控这些靶点发挥干预AMD的药效作用。
3.4绿茶有效组分最佳配伍结构对AMD斑马鱼眼组织关键靶点表达的影响
由图8可知,与对照组相比,最佳配伍结构组和模型组CTNNB1、JUN、MYC基因表达未出现显著性差异,模型组Akt、BCL-2、EGFR、PI3K、STAT3、TP53、TNF基因表达量显著降低(P<0.05、0.01、0.001),BAX、HIF1A、IL6、VEGFA基因表达量显著升高(P<0.05、0.01、0.001);与模型组相比,最佳配伍结构组Akt、BCL-2、EGFR、PI3K、STAT3、TP53、TNF基因相对表达量显著升高(P<0.05、0.01、0.001),BAX、HIF1A、IL6、VEGFA基因相对表达量显著降低(P<0.05、0.01、0.001)。因此得出结论,绿茶有效组分的最佳配伍结构可能通过调控斑马鱼眼组织Akt、BCL-2、EGFR、HIF1A、PI3K、STAT3、TP53、BAX、IL6、VEGFA和TNF基因的表达,激活PI3K-Akt、HIF-1、Apoptosis等多个关键信号通路,发挥干预AMD作用。