
抑郁症是一种以持续心境低落、兴趣丧失为核心症状的慢性精神疾病,全球患者超3.5亿,我国患者逾9 500万[1]。其发病机制极为复杂,传统单胺类递质假说难以全面、深入阐释抑郁症的病理全貌[2]。临床观察发现,抑郁患者常表现出与能量代谢失调的相关核心症状群,包括疲劳感、精力不足、昼夜节律紊乱、认知功能损害、胃肠功能紊乱及运动迟滞等[3]。其伴随的食欲双向改变(暴食/厌食交替)、疼痛敏感性增高等特征表型,进一步印证了机体能量代谢稳态失调的病理本质:下丘脑-垂体-肾上腺轴亢进与线粒体氧化磷酸化效率下降共同导致三磷酸腺苷(adenosine triphosphate,ATP)合成减少;这一能量危机正是驱动抑郁症多维临床表型形成的核心病理枢纽。
中医理论认为,“郁证”多因七情内伤致五脏气机失调[4]。线粒体作为广泛分布于全身各组织器官的细胞器,是细胞能量代谢的核心,其功能状态与抑郁症发生、发展紧密相连,且直接影响“五脏”功能[5]。若线粒体功能障碍,则气血亏虚(能量代谢紊乱),脏腑失养(多器官功能衰退),进而“神不守舍”(情志异常)[6]。线粒体质量控制系统(mitochondrial quality control system,MQCS)失衡可引发“能量代谢障碍-氧化还原失衡-免疫失稳态”三位一体的级联反应,最终加重抑郁进程[7]。这一类比为“调和五脏”抗抑郁治则提供了分子生物学依据,并揭示靶向调节线粒体功能可协同改善多脏腑失衡,为抑郁症提供多系统干预的创新性治疗策略。针对抑郁症复杂病理网络,单一靶点药物因作用维度局限导致疗效欠佳且不良反应显著。而中药复方凭借“多成分-多靶点-多通路”特性,成为治疗抑郁症优势策略[8];然其多组分协同效应与治疗机制尚未明晰,制约着临床科学、合理应用。构建MQCS动态监测体系,追踪活性成分群的时空作用,是深入阐明中药复方多级联反应抗抑郁机制、推动中药现代化研究的关键。
1 抑郁症多维度发病机制:从脏腑功能到亚细胞稳态
1.1 五脏气化失谐:抑郁症“形神共病”的中医整体观
抑郁症在中医理论中属“郁证”范畴,其核心病机“气机郁滞”首载于《黄帝内经》,经后世医家发展形成以五脏功能失调为核心的辨证体系[4,9]。据《素问·阴阳应象大论》所述,五脏(肝、心、脾、肺、肾)分别与五志(怒、喜、思、忧、恐)特异性对应,而情志过极可损及相应脏腑功能,破坏“阴平阳秘”稳态,触发“郁证”[10]。值得注意的是,中医强调五脏通过五行生克制化形成动态调控网络,如肝病可传脾、肾、肺,如肝郁乘脾可致运化失职,肝病及肾则精血互化失司,肝火刑肺更引气机逆乱[11]。这种多维传变揭示单一脏腑失调可通过“相生”“相克”“相乘”“相悔”等引发系统性功能紊乱,故抑郁症并不是单纯的“肝郁”,实为“五脏”交互作用失谐所致功能失稳态。临床可见,肝失疏泄致气郁化火、脾虚失运致痰浊内生等证型。此类证型通过“气-血-津液”代谢障碍,引发神经内分泌-免疫网络失衡(如神经炎症与单胺递质异常),与抑郁症的现代病理特征高度吻合[9-10]。相关中医理论阐释了单一脏腑失调如何通过“相生”“相克”“相乘”“相悔”等引发系统性病理连锁反应,为“郁证”的多靶点机制提供了整体观、系统论视角。
1.2 线粒体稳态:抑郁症病理机制的现代诠释
1.2.1线粒体网络演进:抑郁症机制研究的文献计量解析抑郁症的发病机制极为复杂,涉及神经递质失调、炎症机制等多种因素的相互交织,如神经递质缺乏[如5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)、多巴胺] 及脑网络功能障碍。同时,炎症机制释放的细胞因子亦可通过调控神经递质代谢参与抑郁症发生、发展[12]。这些因素相互作用,共同构成复杂网络,为抑郁症的诊断和治疗带来挑战,同时也为未来研究提供了广阔空间。
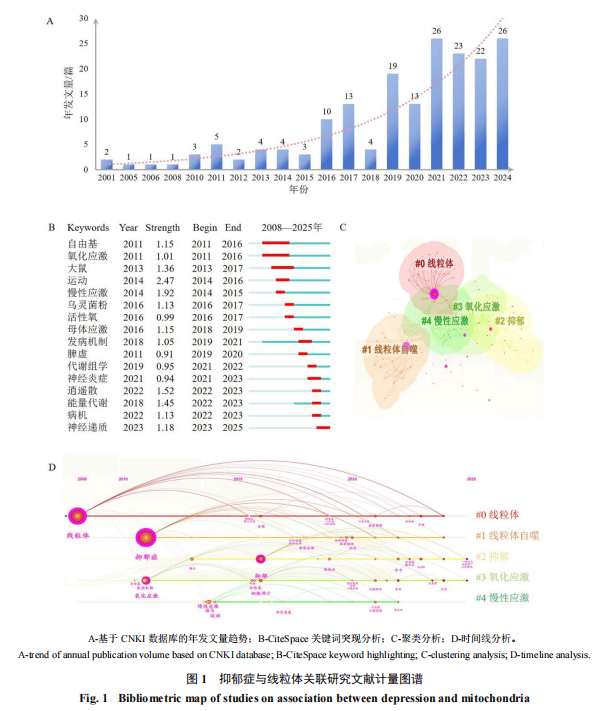
在CNKI数据库中以“抑郁症”和“线粒体”为关键词检索文献,文献计量分析表明(图1-A),其相关研究可追溯至2001年。值得关注的是,自2018年以来该领域研究呈现显著增长态势,年度文献发表量持续突破10篇,并保持稳定上升趋势。
继而,通过Web of Science、Google Scholar、PubMed、CNKI、万方、维普及WHO等数据库进行文献汇总,采用严格的纳入标准,筛选出2008—2025年相关文献共计157篇,并采用CiteSpace对纳入文献进行关键词突显分析、聚类分析及时间线图谱构建。结果显示,抑郁症研究呈现显著的“代谢-神经调控”交叉趋势。突现图谱(图1-B)显示,近年来“能量代谢”与“神经递质”形成动态双核,揭示代谢重编程与突触可塑性的分子互作机制已成为该研究领域前沿。聚类分析(图1-C)进一步解析出“线粒体自噬-氧化应激-慢性应激”三位一体的核心簇群,证实MQCS失衡是串联神经炎症与代谢紊乱的关键枢纽。时间线图谱(图1-D)显示,自2008年以来,线粒体相关关键词始终占据网络中心性首位,其研究焦点从早期病理机制探索(2008—2015年)向动态调控网络解析(2018—2025年)深度演进,标志着抑郁症研究正式进入线粒体介导的多维度分子互作时代。
1.2.2 线粒体功能异常与抑郁症线粒体是真核细胞的能量代谢中心,为细胞提供90%以上的ATP,对维持细胞正常生理功能至关重要[13]。近年来,研究发现线粒体不仅是细胞的“动力工厂”,更是多维度信号调控网络的核心枢纽:通过调控钙稳态、活性氧生成、细胞凋亡通路激活、炎症因子释放等机制,在细胞代谢平衡、突触可塑性维持及神经保护等关键生理过程中发挥核心作用[14-15]。
线粒体功能障碍通过2种主要的病理机制参与或推动抑郁症发生、发展。一方面,降低前额叶皮层线粒体复合物I活性,减少ATP生成,进而抑制突触囊泡循环和单胺类神经递质(如5-HT和NE)释放,破坏“能量-神经递质”的稳态[16];另一方面,线粒体损伤相关分子线粒体DNA(mitochondrial DNA,mtDNA)和线粒体转录因子A(mitochondrial tranion factor A,TFAM)的异常释放会激活小胶质细胞,促使白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎因子异常分泌,从而抑制海马区的神经发生[17-18]。这2种机制共同导致突触可塑性损伤和神经网络失稳态,亦确立了线粒体功能障碍在抑郁症发病中的核心地位。
实验研究表明[19],线粒体功能障碍介导抑郁样行为。患者的线粒体基因组改变和mtDNA缺失可抑制呼吸链复合体活性,导致ATP合成减少和乳酸堆积,诱发神经元能量代谢危机[20]。胡齐[21]发现超氧化物歧化酶、谷胱甘肽过氧化物酶等线粒体抗氧化酶活性降低,丙二醛等脂质过氧化产物累积,继而激活核因子-κB通路引发神经炎症反应,与抑郁症的脑内炎症假说相呼应。此外,线粒体氧化磷酸化障碍通过抑制脑源性神经营养因子/哺乳动物雷帕霉素靶蛋白信号通路,降低突触可塑性和树突棘密度[22]。
综上,线粒体能量代谢危机通过基因表达异常、氧化应激级联反应及突触功能失调,最终导致神经网络紊乱。上述机制表明,“内源性损伤-系统性能量代谢紊乱-神经内分泌免疫调控失调”三位一体的病理框架可系统揭示抑郁症的线粒体功能障碍机制。
2 线粒体质量控制失衡:抑郁症的多维病理枢纽
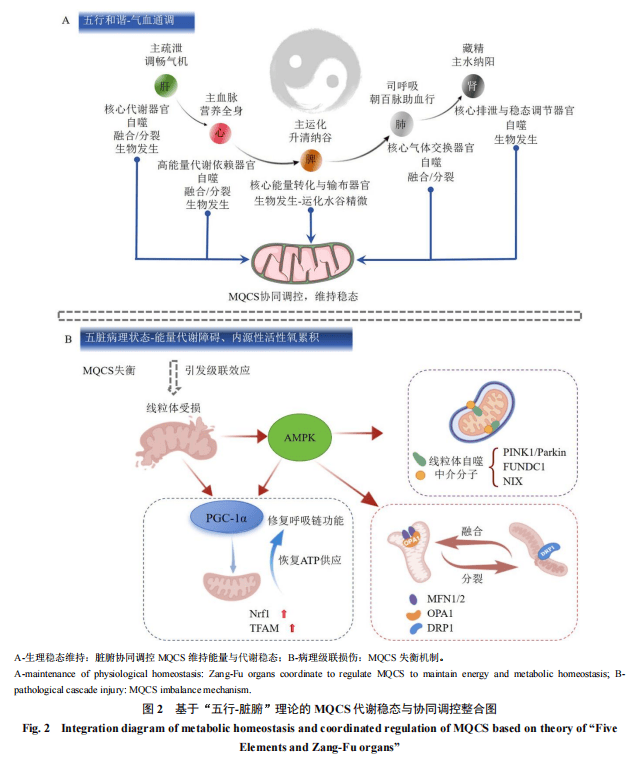
线粒体作为细胞能量工厂,其功能障碍是抑郁症病理进程的核心驱动因素;而五脏作为人体能量代谢调控中心,通过协同指挥MQCS,整合多器官代谢网络,调节能量流的“升降出入”动态平衡,最终实现“五行和谐-气血通调”的能量稳态(图2-A)。此外,深入病理机制,揭示线粒体功能障碍触发MQCS失衡引发级联效应(图2-B)[23]:受损线粒体激活腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)信号轴,触发PTEN诱导假定激酶1(PTEN-induced putative kinase 1,PINK1)/Parkin、FUN14结构域相关蛋白1(FUN14 domain-containing protein 1,FUNDC1)、NIP3样蛋白X(NIP3-like protein X,NIX)等介导的线粒体自噬通路以清除异常线粒体,并通过动力相关蛋白1(dynamin-related protein 1,DRP1)或线粒体融合蛋白2(mitofusin 2,MFN2)调控“融合-分裂”动态平衡维持线粒体网络重构;同时,过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)驱动的生物发生程序促进新生线粒体生成,重构膜结构与蛋白质稳态,保障氧化磷酸化效能及ATP持续供给。MQCS失衡会破坏其“自噬清除-动态重构-新生合成”三位一体的代偿机制,最终导致能量代谢系统崩溃和神经功能损伤。
2.1 线粒体生物发生障碍驱动抑郁症能量代谢重构
线粒体的生物发生是指其通过增殖,替换受损线粒体或增加新线粒体以维持细胞稳态的过程[24]。线粒体生物发生障碍通过抑制PGC-1α/核因子E2相关因子1(nuclear factor E2 related factor 1,Nrf1)信号通路活性[25],在抑郁症中表现为关键能量代谢基因(如Nrf1、TFAM)表达下调,同时激活NADPH氧化酶4(NADPH oxidase 4,NOX4)介导的氧化应激级联反应。相关研究表明,线粒体生物发生障碍可抑制能量代谢基因表达并上调NOX4介导的氧化应激,驱动抑郁症相关能量代谢重构。已有研究结果提示,靶向线粒体生物发生是潜在的治疗抑郁症策略。临床证据显示,抑郁症患者大脑皮质、海马、前额叶皮质等脑区线粒体功能障碍普遍存在,其呼吸功能及ATP生成受抑制,并伴随形态数量改变,如肿胀、嵴减少等[26]。此外,氧化应激诱发线粒体功能障碍(如活性氧介导线粒体生物发生抑制及呼吸链活性降低)并抑制能量代谢相关酶(如氧化磷酸化关键酶)活性,从而干扰细胞能量代谢过程,导致ATP生成不足,诱发或加重抑郁症[27]。
综上,氧化应激通过攻击线粒体脂质、蛋白及DNA,进一步抑制生物发生关键因子,同时减少呼吸链酶活性,形成“活性氧累积-线粒体损伤-能量代谢崩溃”的恶性循环。而线粒体生物发生既增强细胞抗氧化能力,又可通过编码呼吸链复合物减少活性氧产生,降低细胞损伤[28]。故而,靶向线粒体生物发生(激活PGC-1α轴)可通过增强抗氧化能力及修复氧化磷酸化功能,逆转能量代谢重构,有望成为治疗抑郁症的新策略。
2.2 线粒体融合/分裂失衡介导神经网络稳定性破坏
线粒体动力学稳态由融合与分裂的协同调控维持,是决定线粒体形态和功能的核心机制[29]。生理状态下,融合主导时线粒体形成延展性网络结构,促进基质内容物交换及能量均质化分布;而分裂占优时,线粒体碎片化,并可通过选择性自噬清除损伤组分维持质量控制[30-31]。金晶[32]发现抑郁小鼠内侧前额叶皮层脑区的线粒体功能障碍、线粒体分裂增加,影响了兴奋性突触传递,进一步损伤突触功能。提示此类病理改变通过损害神经网络同步性和突触修剪异常,最终影响或参与抑郁症突触丢失、神经发生抑制及认知-情绪障碍。
线粒体动力学失衡(MFN1/2或视神经萎缩蛋白1下调、DRP1过表达)可导致神经元突触可塑性受损[33]:过度分裂引发线粒体碎片化,破坏突触前末梢ATP供应及钙缓冲能力,抑制神经递质释放;而融合缺陷则削弱线粒体网络互连性,阻碍损伤修复并加剧活性氧异常累积[34]。其动力学功能障碍可导致神经发育异常和相关情感疾病的发生。有研究表明[35],线粒体动力学失衡可导致神经元突触可塑性受损,且该种损伤与抑郁样行为的调节密切相关。此外,杨萍芬等[36]发现DRP1的遗传学减少通过恢复线粒体氧化磷酸化功能,改善兴奋性突触传递缺陷,从而缓解慢性应激诱导的抑郁样行为。综上,DRP1是治疗抑郁症的潜在靶点。
2.3 线粒体自噬缺陷引发神经炎症与突触可塑性损伤
线粒体自噬作为选择性清除受损线粒体的质量控制机制,在维持神经元线粒体稳态中发挥关键作用[37]。研究表明,慢性应激可诱发线粒体动力学异常,导致线粒体损伤及活性氧累积,通过触发神经细胞程序性死亡参与抑郁症病理进程[30]。该过程中线粒体自噬的激活缺陷可能阻碍异常线粒体的清除,加剧神经可塑性损伤,从而参与抑郁症发生、发展。
不同通路在不同应激条件下被激活,经典线粒体自噬通路PINK1/Parkin,负责清除严重受损线粒体,线粒体自噬受体则通过泛素依赖或非依赖途径调控缺氧时异常线粒体的清除[38]。研究发现,小鼠脑区突触FUNDC1特异性下调可抑制线粒体自噬活性,引发突触线粒体功能障碍及神经元树突复杂性降低,通过激活神经炎症反应和突触可塑性损伤介导抑郁样行为[39]。相反,卢佳静[38]发现激活NIX依赖的线粒体自噬通路可减少应激诱导的氧化损伤和突触丢失,改善抑郁相关行为表型,提示线粒体自噬功能缺陷可能通过“线粒体-突触-炎症”轴参与抑郁症的病理机制。
3 中药复方调控MQCS改善多脏腑功能的抗抑郁作用及机制
3.1 从“肝脾”论治
中医脏腑理论及临床研究表明,抑郁症与情志内伤、慢性精神耗损等密切相关。肝气郁结、木亢乘土的病机可表现为情绪易激惹、焦虑等精神症状,亦可伴发眩晕、巅顶痛等肝经循行异常征象[40]。值得注意的是,部分抑郁患者呈现肝脾气虚阳弱证候特征,如畏寒肢冷等虚寒之象,与《素问·气交变大论》所载“岁木太过,脾土受邪,忽忽善怒,眩冒巅疾”的经典论述形成病理呼应。这一陈述明确指出,肝气横逆犯脾可致脾失健运,临床可见飧泄、纳差、腹胀等消化功能障碍,其现代病理学本质或与肝郁脾虚状态下的肠-脑轴失调及神经内分泌紊乱相关[41]。进一步分析表明,肝脾协同维持气血生化输布的动态平衡:肝主疏泄以调畅气机,脾主运化以化生精微,二者功能失谐导致气血郁滞,继而通过氧化应激、线粒体功能障碍、神经免疫炎症等,引发中枢单胺递质紊乱及边缘系统功能异常,最终形成抑郁相关病理表型。这一理论框架系统阐释了“肝脾失调-气血失和-神机紊乱”介导的抑郁症多维、跨脏腑的病理机制。
近年来多项研究表明,具有“疏肝解郁、健脾合营”功效的中药复方可靶向MQCS,通过多维度、多系统干预线粒体生物合成、能量代谢及炎症-自噬网络等,改善肝郁脾虚相关抑郁样行为。如醒脾解郁方[42]可显著上调肝郁脾虚型抑郁大鼠的肝脏线粒体呼吸链复合物(I、III、IV)活性及Ca2+, Mg2+-ATP酶功能,阻断ATP合成减少所致的离子转运失衡进而产生呼吸链抑制的恶性循环,从能量代谢核心层面改善线粒体功能障碍;逍遥散[43]通过激活AMPK/PGC-1α轴改善线粒体呼吸链损伤,促使ATP合成增加,同步调控肝脏能量代谢与氨基酸代谢通路,进而改善代谢紊乱,体现了“脾主运化”理论下中药复方重建能量稳态间接调控中枢单胺递质合成的功效。此外,逍遥散[44]还可通过上调下丘脑神经元葡萄糖转运蛋白4表达,促进葡萄糖摄取与自噬水平,形成“肝脾-下丘脑”轴调控网络,将外周代谢调控与中枢能量稳态整合,系统改善线粒体功能。小建中汤[45]通过激活PINK1/Parkin通路增强线粒体自噬活性,清除功能失调线粒体并抑制NOD样受体热蛋白结构域3(NOD like receptor family pyrin domain containing 3,NLRP3)炎症小体活化,从“肝主疏泄”理论层面阻断线粒体DNA泄漏介导的神经炎症级联反应,从而减少炎症因子对单胺递质系统的干扰。Li等[46]发现五苓散可通过上调1.8×104转位蛋白表达,增强1.8×104转位蛋白-电压依赖性阴离子通道1介导的线粒体自噬通路,修复线粒体功能障碍,发挥潜在神经保护作用,进而改善抑郁样行为。同时,四逆散[47]被证实可上调线粒体分裂-融合蛋白并增强突触可塑性蛋白表达,重塑线粒体动态平衡,最终促进神经发生与突触重建。在柴胡疏肝散[48]的相关研究中发现,该方剂不仅通过激活腺苷酸活化蛋白激酶/雷帕霉素靶蛋白/UNC-51样激酶1通路,恢复线粒体自噬稳态,还同步减少胶质细胞过度活化与氧化应激,从而改善能量代谢与突触可塑性。而柴胡加龙骨牡蛎汤[49]则侧重于调节自主神经功能紊乱,通过激活海马中α7型烟碱乙酰胆碱受体介导的胆碱能抗炎通路,并磷酸化增强Janus激酶2/信号转导及转录激活因子3信号通路,抑制小胶质细胞的激活,降低中枢炎性细胞因子的表达水平,从而发挥抗抑郁作用。综上,中药复方通过修复呼吸链功能、重塑自噬-炎症平衡、逆转糖代谢稳态失衡,协同修复肝脾线粒体损伤;并可通过“肝脾-脑”轴多脏腑、跨器官协同作用,调节能量代谢、抑制炎症反应发挥神经保护作用。综上,MQCS是连接中医“肝主疏泄、脾主运化”理论与抑郁症现代病理机制的关键桥梁。
3.2 从“心肾”论治
中医证候演变规律及临床流行病学研究均表明,郁证发病机制呈现动态病理转化特征,后期多进展为心肾不交证型[50-51];其病理基础可概括为“脾虚精微失运-气血生化不足-心肾阴阳失济”级联反应链。《素问·灵兰秘典论》提出的“心主神明,肾司作强”理论,从不同脏腑功能维度阐释了“心肾交互”调控精神活动的功效:心火下温肾水以助其气化,肾水上济心火以制其亢盛,二者动态平衡是维持情绪稳定及认知功能的关键。临床流行病学数据显示,心肾不交型郁证高发于围绝经期女性、慢性失眠及老年群体[52-53],其病理特征与特定生理阶段或慢性应激导致的神经内分泌网络紊乱密切相关。进一步研究结果表明,心肾不交引发的“火水未济”状态通过激活炎症小体通路、加剧氧化应激损伤,进而加重边缘系统突触可塑性障碍[53]。上述研究提示,调和心肾是防治郁证的有效策略之一,其可通过调控神经递质稳态、修复线粒体能量代谢及抑制神经炎症等多靶点机制干预疾病进展,体现了中医“形神共调”的整体观和科学内涵。
近年来大量研究提示,靶向MQCS的中药复方以中医“心肾同治”理论为调控基础,多维度干预能量代谢失衡、重塑自噬稳态及稳定线粒体膜电位等关键环节,有效改善心肾不交相关疾病的抑郁样行为。如酸枣仁汤[54]通过增强线粒体电子传递链酶活性(复合体I~IV),重构肝脏能量代谢网络,且间接恢复心肾间能量交互,缓解心肾阴虚或阳虚相关的“抑郁-失眠”共病,从能量代谢角度诠释了“肝肾同源”理论的现代生物学基础;补坎益离丹[55]可抑制DRP1介导的线粒体过度分裂并下调PINK1/ Parkin信号通路的异常激活,精准调控线粒体自噬水平,清除受损线粒体以减少线粒体活性氧对单胺类神经递质(5-HT、NE)的氧化损伤,从而阻断围绝经期心肾阳虚大鼠中“雌激素下降-递质失衡-抑郁”这一恶性循环;而针对脑卒中后抑郁[56],中医“心肾-脑轴”理论进一步阐释了线粒体膜电位下降、呼吸链复合体活性受损等MQCS失调会影响神经内分泌网络,导致单胺递质合成受限,这提示维持膜电位稳定可恢复5-HT/NE能系统功能[57]。除上述方剂外,开心散以益气养心见长,陈公灿[58]证实该方可抑制NLRP3炎症小体介导的线粒体焦亡通路,减少线粒体活性氧生成及炎症因子释放,恢复线粒体稳态与能量代谢,进而减轻神经炎症、保护神经元;而养心汤[59]则侧重补益气血、养心安神,其通过抑制海马神经元Toll样受体4/NOD样受体热蛋白结构域3信号通路介导的“线粒体-炎症”级联反应,有效抑制海马神经元凋亡,从而发挥抗抑郁作用。此外,左归降糖解郁方[60]滋阴益气、化瘀解郁,能调控海马神经元线粒体自噬活性,减轻线粒体损伤和活性氧释放,并多维度改善海马微环境,包括纠正谷氨酸及单胺类神经递质失衡、提升ATP水平、促进突触前膜与后膜相关蛋白表达,最终修复突触可塑性损伤并间接抗抑郁。已有研究表明,中药复方通过多靶点、多途径干预能量代谢重编程、自噬动态平衡及膜电位调控等MQCS关键环节,从分子层面整合调控心肾功能互济与“心肾-脑轴”交互,为改善心肾不交证候的线粒体功能障碍提供新策略,同时揭示了MQCS衔接中医脏腑理论与神经精神疾病病理机制的桥梁作用。
3.3 从“肺”论治
《黄帝内经》脏象理论及现代临床证候相关研究提示,抑郁症发生、发展与肺脏功能失调亦存在多维关联机制。《素问·至真要大论》提出的“诸气憤郁,皆属于肺”理论,揭示了肺脏调控情志的核心地位:肺主气、司呼吸的生理功能失常可直接影响气机升降,导致“肺魄失藏”状态,临床表现为夜寐不安(如浅睡眠、易觉醒)等轻度神志异常,甚则进展为善悲欲哭、情绪失控等典型郁证表型[61-62]。从病机演变角度分析,抑郁症作为“气分病”的重要类型,其发展遵循“肝郁气滞-郁火炼津-痰浊阻肺”病理链条。在此过程中,“脾失健运”导致的痰湿内生与“肺失宣肃”引发的津液输布障碍形成协同效应,致使痰浊壅滞肺络,加剧“气-痰-郁”互结,并形成恶性循环[63]。现代临床观察发现,约37.6%郁证患者合并咳嗽、气短、胸闷等肺系症状;而通过调畅肺气可疏解气机郁滞[45],提示肺脏功能状态与边缘系统情绪调控存在双向病理、生理学关联。这些研究结果从分子层面阐释了“调肺治郁”策略的可行性及其科学内涵:通过宣肃肺气、涤痰通络等治法恢复肺脏主气司呼吸功能,系统性调节神经内分泌-免疫网络,是郁证“痰气郁结”证型治疗的新干预靶点。
近年研究表明,调节肺系疾病相关的中药复方可通过MQCS改善患者伴随的抑郁样行为,其作用机制涉及线粒体自噬、代谢重编程及氧化应激调控等。以血管性痴呆与抑郁症的共性病理机制为切入点,温肺降浊方[64]可通过激活PINK1/Parkin介导的线粒体自噬通路,显著降低神经细胞凋亡率并改善认知功能,提示MQCS调控在神经精神共病中的关键作用。在肺纤维化合并抑郁症的研究中,丹贝益肺方[65]通过重塑碳水化合物代谢、溶血磷脂酰胆碱代谢及氨基酸代谢网络,实现对线粒体生物能学的多靶点调控;温肺化纤汤[66]经AMPK/沉默调节蛋白3信号轴增强线粒体氧化磷酸化效率,该通路不仅改善肺间充质干细胞功能,还可通过脑-肺轴影响中枢能量代谢。值得注意的是,理肺汤[67]对慢性阻塞性肺病的干预研究显示,其通过介导丝裂原活化蛋白激酶/激活蛋白-1信号通路调控,有效抑制氧化应激级联反应,从而维持线粒体膜电位动态平衡。百合地黄汤功擅补益心肺、养阴清热。有研究表明,该方可通过上调B淋巴细胞瘤-2的表达,抑制半胱氨酸天冬氨酸蛋白酶-3介导的线粒体凋亡通路,从而维护肺内神经元结构完整,并协同其抗炎与神经可塑性调节效应,共同发挥抗抑郁作用[68]。这些研究共同揭示了MQCS是肺系疾病与抑郁样行为的一个关键的病理交汇点:线粒体动力学失衡导致的能量代谢障碍、活性氧累积及神经炎症反应,可能构成“肺病及脑”的重要分子基础。中药复方通过多组分协同作用,系统性调控MQCS关键节点(如自噬清除、生物合成、动态平衡),为“肺-脑”共病提供了新型治疗策略。
4结语与展望
抑郁症作为具有时空动态异质性的跨系统紊乱疾病,其发病机制涉及神经递质失衡、线粒体功能障碍、免疫炎症及氧化应激网络、肠道微生态失衡等多维度病理交互作用。本文系统综述了MQCS在抑郁症病理进程中的核心枢纽作用,并基于中医脏腑理论提出了“脏腑-线粒体”互作的创新假说,为未来中医药结合防治抑郁症提供了理论依据与实践基础,推进中医药现代化发展。
线粒体功能障碍通过多条途径参与抑郁症的发生、发展,是当前极具转化价值的关键病理环节。中医诸多治则可通过调控MQCS关键节点实现多靶点协同干预、多通路网络调控。基于“肝脾同调”“心肾交济”“肺脏调控”三大治则的各类中药复方作用于多脏腑、跨系统轴,临床疗效显著。中西医结合、中西药联用在抑郁症治疗中亦展现出创新价值和巨大潜力:中药复方多组分协同作用覆盖大量KEGG通路节点,MQCS作为“脏腑-脑”轴交互核心媒介,使中医整体观转化为可量化指标,相关临床数据也显示出其优势。
在临床应用中,可以线粒体能量稳态为核心,通过三大治则协同重建多脏腑线粒体功能和能量稳态。肝脾同调类方可协调肝代谢解毒与脾能量转化,降低神经炎症;心肾交济类方可同步增强心脑供血与肾排毒功能,保障脑组织血流灌注,维持能量供应链;补肺类方经“肺-脑”轴提升神经元氧能转化效率,直接增加ATP产出。三者通过代谢物交换、循环运输、神经内分泌信号等形成级联调控,协同增强MQCS介导的抗抑郁疗效。
未来研究应立足临床需求,基于真实世界证据深入解析中药复方多靶点作用机制,为精准用药提供理论支撑。并进一步开展多中心临床研究,以期实现从实验数据到临床证据的转化。同时,可引入多学科研究思维、应用多学科交叉技术,借助人工智能辅助分析,为抑郁症的精准化、个体化治疗提供创新策略。





