颅内表皮样囊肿(EC)恶性转化为鳞状细胞癌(SCC)是一种极为罕见的事件,通常通过术后组织学检查确诊。其转化的潜在机制仍知之甚少,与进展相关的基因变化的特征描述有限。一名 55 岁女性因左侧顶盖区可见强化结节的巨大桥小脑角EC就诊,并接受了手术切除。术后 3 个月,顶盖残余成分快速增大,需要再次手术,病理学检查显示为鳞状细胞癌(SCC)。对EC和SCC的下一代测序显示存在多个相同变异,包括一个致病性TP53突变。此外,SCC中含有EC中不存在的致病性PTEN变异,提示第二个驱动突变促成了EC的恶性转化(MTEC)。SCC对容积调强弧形治疗(VMAT)耐药,需后续接受化疗及帕博利珠单抗联合立体定向放射外科治疗。尽管初始反应良好,但患者在MTEC确诊后 26 个月死亡。据研究人员所知,这是首次使用配对分子检测将颅内SCC与EC前体联系起来,提高了这一罕见诊断的准确性。此外,该病例确定了与转化相关的特定基因改变,为MTEC潜在的大部分未知机制提供了新的见解。
背 景
颅内表皮样囊肿(ECs)是一类罕见的先天性肿瘤,占所有颅内肿瘤的 0.2%–1.8%。尽管通常为良性,但少数(0.011%–0.045%)的EC会恶性转化为鳞状细胞癌(SCC)。此外,颅内EC诊断至其恶性转化的间隔时间在文献报道中存在显著差异。桥小脑角(CPA)是这些病变最常见的部位,其次为颞叶、脑桥前角和小脑。
EC恶性转化(MTEC)的潜在机制仍知之甚少,主要因病例罕见且各病例报告间存在异质性。有研究认为,转化可能由次全切除术引发,可能是由于囊肿壁破裂继发的慢性炎症或术中异物植入所致。最近有观点提出,原位癌可能新发并促进EC转化。然而,支持这些假设的进一步研究仍需开展。
目前尚无针对MTEC来源的SCC的标准治疗方案。尽管超过 90% 的患者接受手术治疗,但肿瘤位置常因脑干和神经血管受累而无法完全切除。例如,近期一项文献综述发现,由于脑干粘连,29 例CPA病变患者中仅 2 例实现了完全切除。此外,次全切除术与 >20% 的复发率相关。有研究认为,手术联合辅助治疗可能是最佳方案,尤其是放疗已被证实可带来良好的短期疗效。值得注意的是,目前尚无用于治疗分层的既定生物标志物,且疾病病理生理学证据有限。
据研究人员所知,分子检测此前尚未用于颅内EC恶性转化SCC与其前体病变。此外,对良性和恶性组织的配对分子谱分析可能揭示与EC向SCC转化相关的基因改变。本文描述了一例通过下一代测序确认的MTEC患者病例,显示存在TP53和PTEN致病性突变,并采用包括手术切除、放疗和PD-1抑制剂治疗在内的多模式治疗进行管理。
病 例
患者女,55 岁,右撇子,主诉有 1 年进行性左眼疼痛及间歇性垂直复视病史,以及 2 个月左侧面部麻木病史。MRI显示左侧桥小脑角(CPA)存在一个 5 cm无强化肿块,延伸至内听道,提示为表皮样囊肿(EC)(图1A)。此外,左侧顶盖区内可见一个 0.7×0.8×0.8 mm的强化病灶(图1B),导致大脑导水管轻度狭窄。扩散加权MRI显示左侧桥小脑角区扩散受限,而顶盖强化病灶未见扩散受限(图1C)。随后患者接受了左乙状窦后开颅术,行近全切除术,术后病理学结果符合表皮样囊肿。术后 2 周,患者左侧面部麻木症状缓解,意识清醒且定向完全正常,复视也有轻度主观改善。然而,术后 6 周时,患者主诉复视逐渐加重。此时MRI显示中脑手术区域周围存在水肿,累及动眼神经IV(滑车神经)。经神经眼科团队会诊,建议在患侧左眼试行棱镜镜片矫正,并继续监测后续数月内的潜在恢复情况。
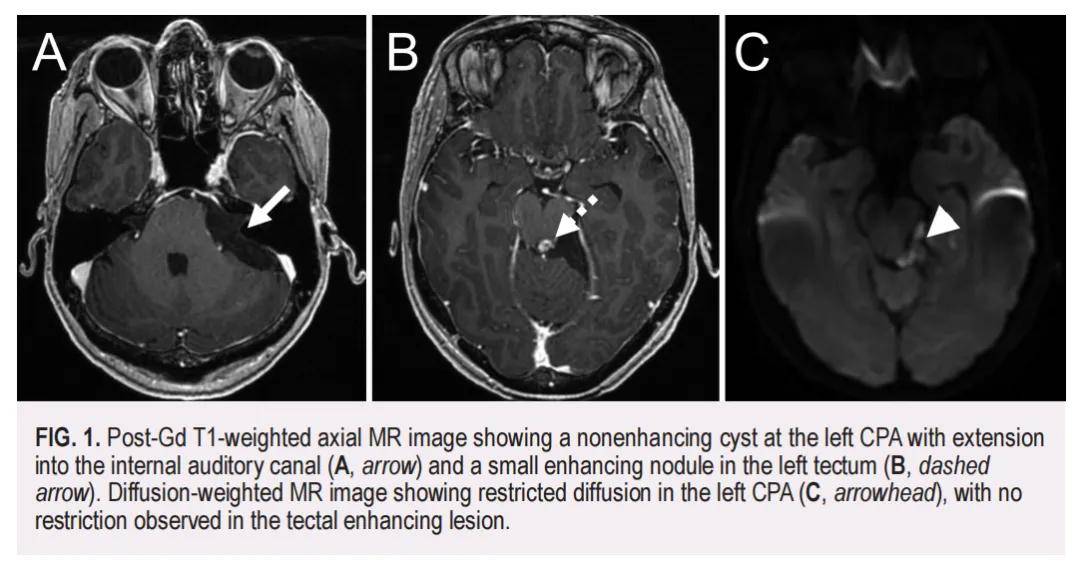
▲图1 T1加权轴位MRI图像显示左侧CPA处有一非强化囊肿,并延伸至内耳道(A,箭头),左侧顶盖处有一小强化结节(B,虚线箭头),弥散加权MRI图像显示左侧CPA处弥散受限(C,箭头),而顶盖强化病变处未见弥散受限
术后 2 个月期间,患者在旅行时出现记忆丧失、意识模糊及平衡障碍。MRI显示脑积水,继发于此前发现的顶盖病变快速增大(图2),伴随大脑导水管受压、脑沟及基底池受压消失。经诊断为梗阻性脑积水,患者于外院接受右侧额叶脑室腹腔分流管置入术治疗。分流管置入术后 2 天,其记忆丧失及意识模糊症状显著改善,但平衡障碍仍持续存在。旅行返回后,计划进行二次切除术。分流管置入术后 1 个月,患者接受顶盖区肿块切除术(此时肿块大小为 2.5×1.5×1.3 cm)。采用远外侧小脑上幕下入路暴露顶盖中脑区,行显微外科切除。为保护导水管周围灰质完整性,在导水管水平残留少量肿瘤组织;此外,因肿瘤下极与中脑及脑桥核极端粘连,约一半下极肿瘤组织残留。
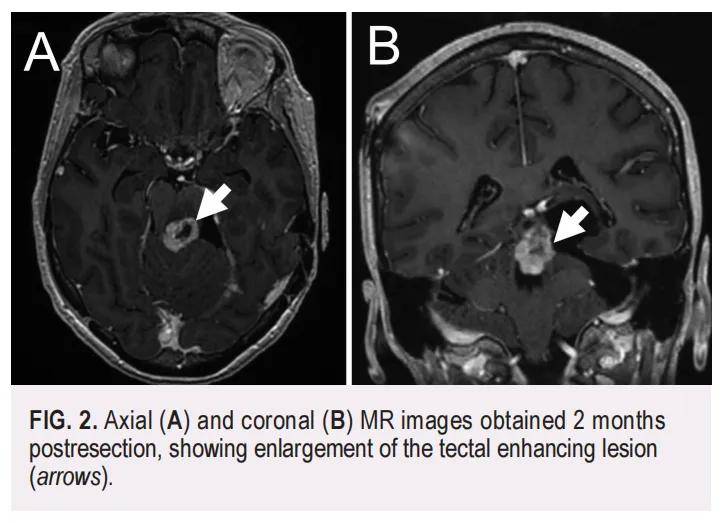
▲图2 切除2个月后的轴向(A)和冠状(B)MRI图像显示顶盖增强病变扩大(箭头)
术后病理学检查证实为中分化鳞状细胞癌(SCC),其PD-L1综合阳性评分(CPS)<1%。此外,对切除的顶盖病变进行的NGS panel检测显示,SCC与原始表皮样囊肿(EC)存在相同变异,包括TP53(F113V,可能致病性)、CASP8[I315V,意义未明变异(VUS)]和MCL1(T38S,VUS)。进一步分析显示,该SCC的肿瘤突变负荷(TMB)为 14.9 muts/Mb。两个样本间的相同变异强烈提示两者存在共享的突变特征,并支持EC作为前体病变,其中致病性TP53突变促进了肿瘤发生。值得注意的是,SCC中还存在一个额外的PTEN变异(D92H,可能致病性),提示这是一个促成疾病进展的第二个驱动突变。在SCC样本中,TP53和PTEN突变的变异丰度(VAFs)分别高达 81% 和 79%。整体而言,这有力支持了初始EC的恶性转化。术后 2 个月的MRI显示,残留肿瘤主要位于切除腔下缘(图3A和B)。患者随后接受了容积调强弧形治疗(VMAT),针对原始EC、切除腔边缘及顶盖次全切除的强化区域,处方剂量为 54 Gy(分 30 次照射)。VMAT治疗后 5 个月的随访MRI显示治疗反应良好,顶盖病变体积缩小(图3C和D)。然而,VMAT治疗 1 年后,患者出现复视加重,并伴有右手和右脚麻木。此时MRI显示左侧顶盖不均质强化肿块出现间隔期增大(大小为 2.6×1.9×2.6 cm),并观察到中心扩散受限及动脉自旋标记(ASL)信号增强,提示肿瘤复发(图4)。后续PET/MRI显示该病灶有显著氟代脱氧葡萄糖摄取。
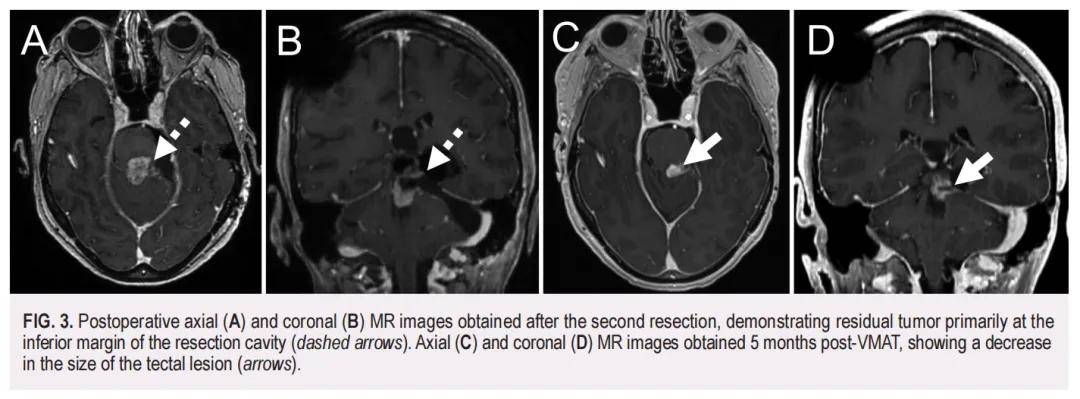
▲图3 第二次切除后获得的术后轴向(A)和冠状(B)MRI图像,显示残留肿瘤主要位于切除腔的下缘(虚线箭头)。VMAT 术后 5 个月获得的轴向(C)和冠状(D)MRI图像显示顶盖病变尺寸减小(箭头)

▲图4 治疗前Gd T1加权轴向 MR 图像显示左顶盖中心存在不均匀增强的复发性结节性肿块(A),外周ASL信号增强(B),中央扩散限制增强(C)(箭头)
尽管患者此前PD-L1综合阳性评分(CPS)<1%,仍决定开始采用卡铂、紫杉醇联合帕博利珠单抗治疗。这一决策基于CheckMate-227和KEYNOTE-407两项PD-1抑制剂试验的结果,其显示无论肿瘤PD-L1表达状态如何,该方案均能带来生存获益。此外,计划同步进行免疫治疗与放疗,以利用两种治疗在激活免疫系统中的潜在协同作用。随后,患者接受了射波刀立体定向放疗(SRS),针对 68% 等剂量线处方 27.5 Gy(分 5 次照射)。射波刀治疗后 2 个月,MRI显示顶盖病变体积轻度缩小,动脉自旋标记(ASL)信号显著减弱;左侧脉络膜裂残留表皮样囊肿(EC)呈扩散受限,体积稳定(图5)。然而,患者出现运动功能逐渐减退、视力下降、言语困难、平衡能力降低及行走障碍。此时MRI显示血管源性水肿改善,射波刀治疗区域无明显肿瘤增大,未观察到局部复发或进一步恶性扩散。由于日常功能减退,患者选择不再接受进一步全身治疗。射波刀治疗 7 周后,患者进入临终关怀,5 周后不幸离世,距MTEC初诊已 26 个月。
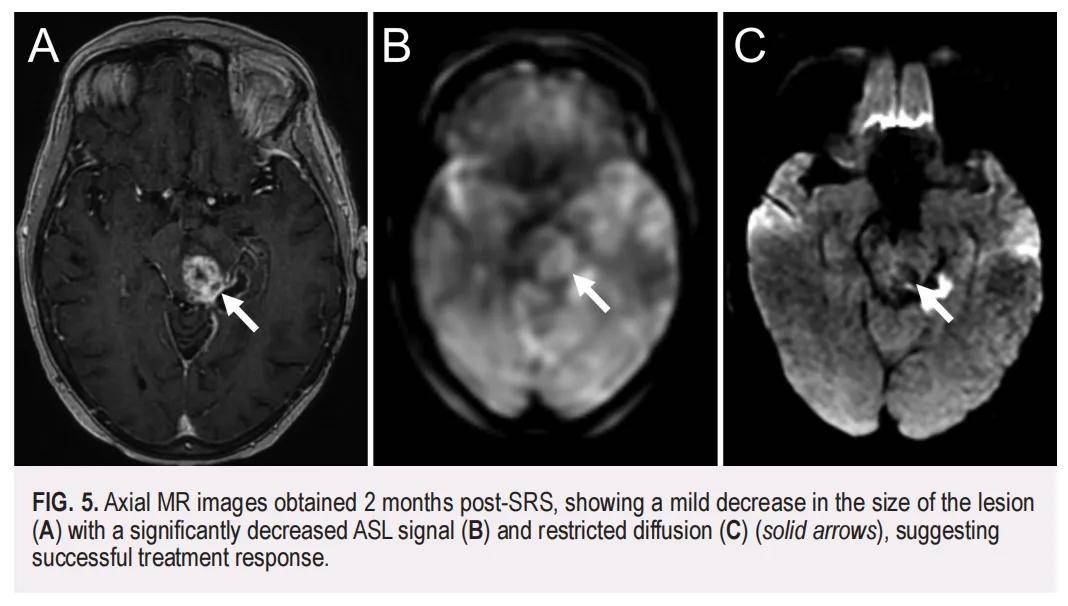
▲图5 SRS治疗后 2 个月获得的轴向MR图像显示病变大小略有减小(A),ASL信号显著降低(B)且扩散受限(C)(实线箭头),表明治疗反应成功
讨 论
本文首次报道了通过突变谱分析将颅内鳞状细胞癌(SCC)与表皮样囊肿(EC)前体病变关联的应用。目前,恶性转化性表皮样囊肿(MTEC)的诊断标准仍仅基于解剖部位和术后组织学。1981 年,Garcia等人将MTEC定义为局限于硬膜内间隙、未侵犯颅内孔道或蝶鞍、且无鼻咽部病变的肿瘤。2005 年,Hamlat等人扩展了这一标准,进一步排除了包含良性鳞状上皮的恶性病变及存在癌转移证据的病变。尽管此前有 1 例关于起源于EC的原发性颅内SCC基因谱的报道,但该研究未提供EC的基因谱,因此难以识别与恶性转化相关的特异性改变。值得注意的是,该研究描述了SCC中存在致病性PTEN变异,与本文患者的情况相似。此外,已有研究通过免疫组化在MTEC中发现TP53突变,但缺乏全面的基因检测。
MTEC的分子分类有可能提供超越组织学特征的有力证据,增强诊断准确性,确保肿瘤得到正确分类。鉴于颅内EC在次全切除术后复发率高达 21%,这一分类方法可能尤为重要。此外,分子谱分析可能使临床医生仅需较传统组织学更少的组织量即可区分SCC与EC。由于MTEC的鉴别诊断包括转移癌、原发性SCC及其他原发性恶性肿瘤,明确诊断对制定治疗方案可能具有关键价值。
通过基因谱分析识别患者初始EC与后续SCC的共享变异,强烈提示两者具有共同的突变特征(即克隆性),支持前者作为前体病变。此外,两种病变中均存在的致病性TP53变异是已知的致癌驱动因子。值得注意的是,SCC中还存在一个额外的致病性PTEN变异,可能构成第二个驱动突变。这与Vogelstein等提出的肿瘤进展遗传模型一致——癌症是 2-8 个外显子“驱动”突变(driver mutation)的结果,伴随不直接促进肿瘤发生的“乘客”突变(passengers mutation)。此外,SCC中两种基因的变异等位基因频率(VAFs)显著升高,其中TP53从良性EC前体的 1% 升至 81%。
MTEC分子检测还可能提供预后生物标志物以指导治疗。例如,高肿瘤突变负荷(TMB,定义为 ≥10 muts/Mb)已被证实可预测帕博利珠单抗的客观缓解率,且与PD-L1表达无关。在多项非小细胞肺癌大型前瞻性研究(包括CHECKMATE-227和KEYNOTE-048临床试验)中,帕博利珠单抗对PD-L1阴性肿瘤显示出获益。这与本文患者的情况一致——其TMB为 14.9 muts/Mb,尽管PD-L1表达 <1%,但联合射波刀(SRS)治疗仍显示出良好反应。尽管肿瘤数量、体积、组织学特征及切除范围传统上被用作脑癌复发的预测因素,但分子生物标志物正越来越多地被纳入术后复发风险评估。此外,分子特征近期已为脑膜瘤和胶质母细胞瘤的病理生理学及风险分层提供了重要见解。
抑癌基因PTEN和TP53是癌症中突变频率极高的基因。TP53(肿瘤蛋白p53基因)是研究最广泛的凋亡调控因子之一,参与细胞对多种应激的存活反应。值得注意的是,本文患者中的TP53 F113V变异位于DNA结合域,可能导致部分或完全功能丧失。TP53突变与多种恶性肿瘤(包括胶质瘤、神经母细胞瘤和尤因肉瘤)的放疗耐药相关。本文患者的SCC对容积调强弧形治疗(VMAT)显著抵抗,需进一步联合免疫治疗与SRS。TP53功能丧失可能导致患者对VMAT反应不佳,这一推测也得到该突变高VAF(81%)的支持,提示其存在于大量肿瘤克隆中。
PTEN(磷酸酶与张力蛋白同源物)是一种具有蛋白磷酸酶和脂质磷酸酶活性的双特异性蛋白。PTEN D92H变异已知会影响磷酸酶张力蛋白结构域,体外研究已证实其功能丧失。此外,PTEN功能丧失与头颈癌进展、表皮增生及胶质母细胞瘤相关。值得注意的是,尽管PTEN和TP53各自突变频率很高,但二者同时突变并不常见,可能由于它们在PTEN-TP53通路中的相互作用。这提示EC可能在同一通路的不同基因中发生二次“打击”,共同促成恶性转化。然而,由于本报告为观察性研究,无法明确证实观察到的TP53和PTEN突变与EC转化的因果关系,因此需进一步研究以明确这些变异在MTEC中的具体作用。
近期一项关于MTEC进展为SCC的系统综述提示,最佳治疗方案为手术联合辅助治疗。然而,在总生存期(OS)最长的治疗组(手术+辅助治疗组)中,中位OS仅 13 个月;相比之下,单纯手术或化疗患者的OS分别为 3 个月和 6 个月。因此,本文患者 26 个月的OS属于相对良好的结局。据研究人员所知,这是首次报道PD-1抑制剂联合SRS治疗该病变。此外,目前仅有 5 例已发表的SCC治疗中应用SRS的病例。综上,免疫治疗联合SRS可能值得进一步研究以用于MTEC治疗。
需要说明的是,本文患者帕博利珠单抗联合SRS反应的评估仅持续 3 个月,提示需要更多研究以明确长期疗效。然而,多项既往研究表明,SRS后短期肿瘤体积缩小可能预示长期局部控制。此外,治疗后低ASL信号强度反映良好反应。基于此,考虑到MTEC的罕见性,研究人员观察到的短期局部控制可能具有参考价值。
由于颅内恶性转化性表皮样囊肿(MTEC)发病率低,关于其进展机制的信息有限。本文首次报道了鳞状细胞癌(SCC)与其表皮样囊肿(EC)前体的配对分子分析,揭示了与恶性转化相关的突变。这为MTEC提供了一种分子诊断方法,其准确性超越了单一的组织学特征。值得注意的是,TP53和PTEN致病性变异的存在(后者仅在SCC中发现,而未见于EC)提示这些变异可能作为驱动因子参与肿瘤进展。此外,本例患者通过多模式治疗(包括切除术、容积调强弧形治疗[VMAT],以及首次针对该病变应用的帕博利珠单抗联合射波刀[SRS]同步治疗),显示出良好的局部控制效果和总生存期(OS)。
我司实体瘤全外显子组基因检测、实体瘤1299基因检测NGS大panel可检测TMB,符合相关指南共识要求;还能指导患者靶药、免疫、化疗、遗传等,满足肿瘤患者多样化检测需求。

▲绘真医学相关产品
专家共识指出,TMB检测所使用的靶向测序panel原则上不应小于 1 Mb,同时应尽可能涵盖更多的其他分子遗传信息。专家共识还指出,在各个癌种中应使用相同的筛选策略,用“五分位法”选择排序在 20% 以上的病例定义为TMB-H组。纪念斯隆-凯特林癌症中心(MSKCC)分析了涉及 10 个癌种的 7033 名患者数据,证实了TMB-H与接受ICIs治疗患者更好的总体存活率相关[2]。研究还发现,TMB值最高的 20% 的患者,与剩下的 80%的患者相比,ICIs治疗后总生存率更高。统计表明,随着TMB阈值的增加,死亡风险比(HR)在 20% 阈值前后差异化相当明显。证明不同癌种中,预测ICIs治疗效果的TMB阈值用前 20% 来确定比较合理,即“五分位法”。

▲摘自《肿瘤突变负荷检测及临床应用中国专家共识(2020年版)》

▲摘自《肿瘤突变负荷检测及临床应用中国专家共识(2020年版)》

▲MSK研究结果
参考文献:
Harary, P. M., Hori, Y. S., Kassu, R., Persad, A. R. L., Tayag, A., Ustrzynski, L., Emrich, S. C., Gibbs, I. C., Park, D. J., Chang, S. D., & Fernandez-Miranda, J. C. (2025). Paired molecular profiling of malignant transformation of an epidermoid cyst for potential genetic drivers: illustrative case. Journal of Neurosurgery: Case Lessons, 9(18), CASE24849. https://doi.org/10.3171/CASE24849





