编者按:胃癌作为全球高发的恶性肿瘤之一,HER2阳性亚型约占患者总数的20%,其治疗一直是临床研究的重点方向。德曲妥珠单抗(Trastuzumab Deruxtecan,T-DXd)作为一种靶向HER2的抗体药物偶联物(ADC),在HER2阳性胃癌治疗中展现出积极的抗肿瘤活性和生存获益。cGAS-STING通路作为先天免疫的关键通路,在肿瘤免疫监视和抗肿瘤免疫应答中扮演着重要角色,为靶向治疗与免疫治疗的联合应用提供了新的理论基础。韩国首尔国立大学研究团队在Cell Communication and Signaling发表的研究,系统揭示了T-DXd通过激活cGAS-STING通路调控胃癌细胞免疫应答的分子机制,为优化胃癌治疗策略提供了重要实验依据。
1
核心研究结果
T-DXd诱导胃癌细胞DNA损伤并发挥广谱抗肿瘤活性
研究发现,T-DXd对不同HER2表达水平的胃癌细胞均具有显著的增殖抑制作用,且生长抑制率与HER2 mRNA表达水平呈正相关。与曲妥珠单抗相比,T-DXd在HER2低表达(SNU-484)和极低表达(SNU-601)细胞中仍能有效抑制克隆形成,抑制率分别达47.04%和20.57%。细胞周期分析显示,T-DXd可诱导所有测试细胞系出现G2/M期阻滞和SubG1群体增加,提示具有凋亡诱导作用。机制上,T-DXd处理后ATM、Chk2及组蛋白H2A.X的磷酸化水平升高,彗星电泳实验证实其存在DNA双链断裂形成,Rad51灶点增多,表明DNA损伤应答(DDR)通路被激活,且该效应不依赖于HER2表达水平。
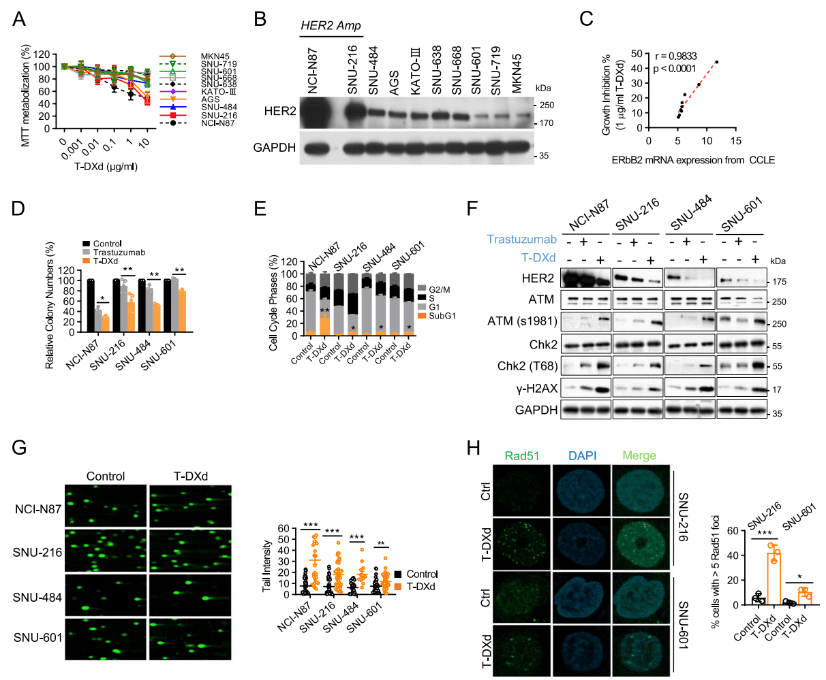
图1. T-DXd诱导DNA损伤反应,并对具有不同HER2表达水平的GC细胞系产生强烈的细胞毒性作用
DDR通路激活通过IRF1调控PD-L1转录
T-DXd处理可显著上调不同HER2状态胃癌细胞的PD-L1表达,且在转录水平和细胞表面表达均有体现。使用ATM和ATR抑制剂干预发现,双重抑制ATM和ATR可有效阻断T-DXd介导的PD-L1上调,而单独ATR抑制仅部分逆转该效应。免疫印迹结果显示,PD-L1表达与转录因子IRF1水平密切相关,siRNA介导的IRF1敲低可显著减弱T-DXd诱导的PD-L1表达升高,表明T-DXd通过激活DDR通路,经IRF1调控PD-L1转录表达。
T-DXd重塑免疫相关基因表达特征
为了全局性地理解T-DXd的免疫调节作用,研究人员对经T-DXd处理后的HER2高表达(NCI-N87)和低表达(SNU-484)胃癌细胞进行了RNA测序(RNA-Seq)分析(图2)。RNA-Seq分析显示,T-DXd处理后NCI-N87细胞中出现1010个差异表达基因,其中675个上调基因富集于炎症反应、α干扰素应答等7个抗肿瘤免疫相关hallmark基因集。GO功能分析和GSEA证实,T-DXd显著富集I型干扰素应答、抗原加工呈递等免疫调节相关生物学过程。在SNU-484细胞中,T-DXd同样显著富集干扰素α/γ信号通路相关基因集,提示其免疫调节作用不局限于HER2阳性胃癌细胞。值得注意的是,T-DXd可特异性诱导IFN-I信号通路基因表达,而曲妥珠单抗无此效应。
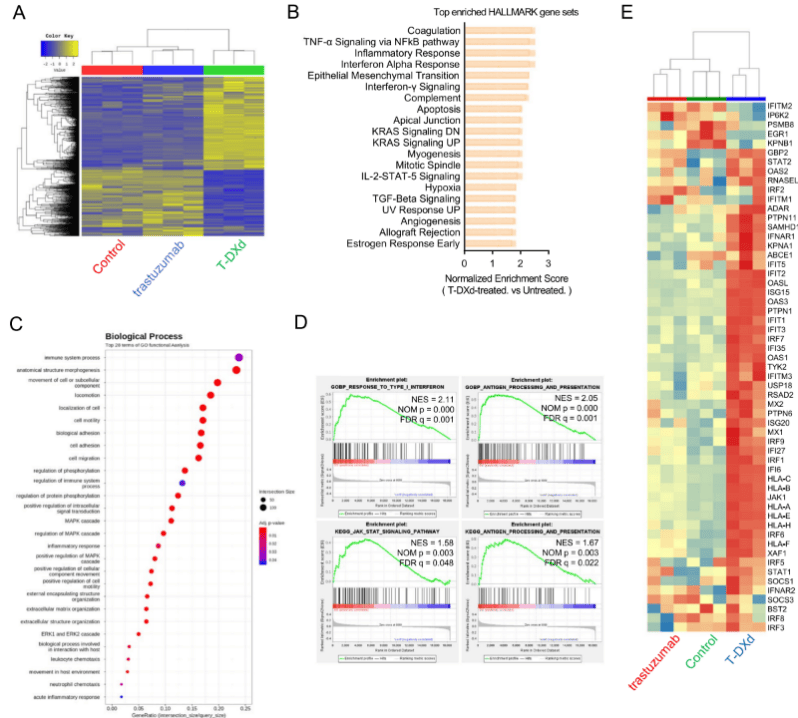
图2. T-DXd在HER2高表达和低表达的胃癌细胞系中诱导与肿瘤免疫原性增强相关的基因表达特征
T-DXd激活cGAS-STING通路介导IFN-I应答
机制探索发现,T-DXd处理可诱导TOP1cc形成并促进微核(MN)产生,约10%的微核同时表达γ-H2AX和TOP1cc,提示TOP1cc介导的DNA损伤参与微核形成。进一步研究证实,T-DXd可促进胞质dsDNA释放,该过程主要依赖ATR而非ATM调控。T-DXd处理后,胃癌细胞胞质cGAS表达上调,STING、IRF3、TBK1、NF-κB、STAT1/3等通路分子磷酸化水平升高,细胞内cGAMP含量增加,IFNβ1、CXCL10、IFIT1等干扰素刺激基因(ISGs)转录激活,CCL5和CXCL10分泌增多。
为了确认cGAS在此通路中的必要性,研究人员使用了siRNA敲低cGAS。结果发现,siRNA介导的cGAS敲低可显著抑制T-DXd诱导的IRF3和STAT1磷酸化,阻断ISGs上调和趋化因子分泌,而外源性补充cGAMP则可以部分恢复因cGAS敲低而受损的IRF1诱导(图3)。证实cGAS-STING通路是T-DXd诱导IFN-I应答的核心机制。
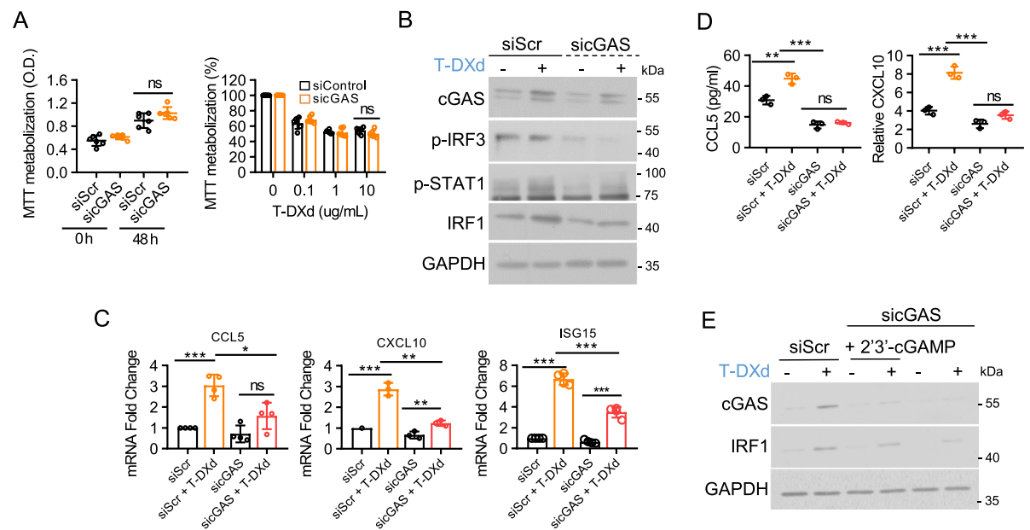
图3. cGAS是T-DXd介导胃癌细胞IFN-I应答增强的关键因子
T-DXd通过cGAS-STING-IFN轴激活DC并增强CD8+T细胞杀伤活性
共培养实验显示,T-DXd处理后的NCI-N87细胞可显著上调TDDCs表面CD86和HLA-DR表达,而曲妥珠单抗无此效应。STING抑制剂或IFN-I中和抗体预处理胃癌细胞,可显著减弱T-DXd介导的TDDCs活化;cGAS敲低也得到类似结果,且cGAMP转染可恢复DC活化表型。
Transwell实验表明,细胞间直接接触或囊泡介导的物质转移是DC活化的必要条件,而可溶性因子单独作用不足以激活DC。进一步研究发现,T-DXd可促进胃癌细胞释放含DNA的外泌体,该外泌体可有效上调TDDCs表面HLA-DR表达,提示外泌体DNA在DC活化中的作用。PBMC共培养实验显示,T-DXd预处理的胃癌细胞可显著增强PBMC的肿瘤杀伤活性,且CD8+T细胞表面CD69激活标志物表达升高,胞内颗粒酶B和IFN-γ分泌增加,表明T-DXd可通过激活适应性免疫应答增强肿瘤杀伤。
cGAS表达与胃癌患者的免疫浸润微环境形成相关
TIMER2.0数据库分析显示,胃癌患者肿瘤组织中cGAS表达水平与髓样DC(尤其是活化亚型)、M1巨噬细胞浸润呈正相关,且与效应记忆型和中心记忆型CD8+T细胞浸润密切相关,而与初始CD8+T细胞无显著关联,证实cGAS通路激活与胃癌患者的抗肿瘤免疫微环境形成相关,为临床转化提供了依据。
2
结论
本研究证实,T-DXd通过诱导DNA损伤激活DDR通路,经IRF1调控PD-L1转录表达,同时通过TOP1cc介导的胞质dsDNA释放激活cGAS-STING-IFN-I通路,促进DC活化和CD8+T细胞介导的肿瘤杀伤。该机制在不同HER2表达水平的胃癌细胞中均成立,且cGAS表达与胃癌患者免疫细胞浸润密切相关。这些发现揭示了T-DXd独特的免疫调节特性,为其与免疫检查点抑制剂联合治疗胃癌提供了充分的理论依据,有望进一步扩大获益患者群体,改善胃癌治疗的临床结局。
本资料仅供医疗卫生专业人士参考,请勿向非医疗卫生专业人士发放





