2025 年 10 月 30 日,由陈孝平院士领衔的中华医学会外科学分会肝脏外科学组,正式发布了《肝细胞癌外科治疗方法的选择专家共识(第 4 次修订)》。这份共识是一份最新的「临床导航图」,为外科实践提供了关键决策方案。本文将为您划出重点,解读变化。
本次共识的制定方法学更为严谨,采用 GRADE 系统(推荐分级的评价、制定和评估) 对证据进行分级,并结合《牛津循证医学中心分级 2011 版》,将证据等级分为 1~5 级,推荐强度分为 A(强推荐)、B(中等推荐)和 C(弱推荐)。对于证据不足的部分,采用 Delphi 法(德尔菲法) 形成共识,共识度需 ≥80% 才能最终确认。
一、肝癌分类与根治标准:界定更清晰,标准更严格
1. 肿瘤分类:四大类型,指导初始策略
微小肝癌:≤1.0 cm
小肝癌:>1.0 cm 且 ≤5.0 cm
大肝癌:>5.0 cm 且 ≤10.0 cm
巨大肝癌:>10.0 cm
临床价值:随着影像学进步,1 厘米肝癌的诊断已非常精准。此分类直接关联到后续手术、消融等治疗方案的选择,实用性极强。
2. 根治标准:术中术后,双管齐下
要想实现根治性切除,必须同时满足术中和术后两套标准。
术中标准(四项必须同时满足):
肝静脉、门静脉、胆管主干及下腔静脉等重要血管未受侵犯;
无肝门淋巴结及远处转移;
严格按照肝段、叶等解剖单位完整切除肿瘤;
切缘>1.0 cm;若<1.0 cm,则残肝断面术中冰冻病理必须报 阴性」。
术后标准(术后 2 个月内验证):
超声造影、增强 CT 或 MRI(至少含两项)检查未发现残留病灶;
若术前甲胎蛋白(AFP)或异常凝血酶原(PIVKA-II)升高,术后 2 个月内需降至正常范围。
二、肝切除术适应证:「 肝储备功能 」 成为硬指标
共识强调,决定能否切肝,需进行三重评估:全身情况、肝功能、病灶情况。
全身与肝功能是前提:
全身状况:好(体能状况评分 0-1 分),无心、肺、肾等重要脏器功能障碍。
肝功能:Child-Pugh A 级,或 B 级经短期护肝治疗后恢复至 A 级。
肝储备功能:ICG R15(吲哚菁绿 15 分钟滞留率) 需在拟切除范围的安全阈值内。
剩余肝体积(FLR):这是硬核指标。正常肝脏,FLR > 30% 标准肝体积;有肝硬化等背景的肝脏,FLR 需 > 40% 标准肝体积。
病灶情况决定手术性质:
可根治:单发,或局限于一叶/相邻叶段的多发肿瘤。
可切除+辅助治疗:肿瘤范围广、侵犯肝门、有淋巴结转移或侵犯周围脏器,可考虑新辅助治疗后手术或术后辅助治疗。
三、手术方式之争:解剖性切除(AR)与非解剖性切除(NAR)
核心原则:不再 「 一刀切 」,而是基于肝储备功能和肿瘤生物学行为做个体化选择。
首选 AR(解剖性切除)的情况:肝储备功能良好,尤其是肿瘤直径 2~5 cm,或术前影像怀疑存在微血管侵犯(MVI) 等高侵袭性因素时。
选择 NAR(非解剖性切除)的情况:肝硬化重、肝储备功能差(如 ICG R15 > 20%),为避免术后肝衰竭,应优先保肝,选择 NAR。
依据:日本超 7 万例大数据证实,对于 2~5 cm 的肝癌,AR 能带来生存获益。
四、复发肝癌:摒弃姑息,积极再切除
肝癌术后 5 年复发率高达 50%~70%,但共识明确:复发不等于末路,应积极干预。
首选策略:只要条件允许,再次手术切除的预后依然优于消融、介入等非手术治疗。
决策参考:
复发时间:术后 1 年以上复发者,再手术效果通常优于 1 年内复发者。
综合治疗:不宜手术者,应积极采用靶向治疗、免疫治疗、肝动脉插管化疗栓塞术(TACE)、消融等综合手段。
终极手段:符合条件的患者可考虑补救性肝移植。
五、转化治疗:为 「不可切」 患者打开希望之门
对于初始不可切除的肝癌,通过靶向、免疫、TACE、门静脉栓塞术等综合手段,可使肿瘤缩小(降期)或剩余肝体积增大,从而赢得手术机会。
关键点:转化成功后,必须像对待初始可切除患者一样,重新全面评估肝功能和 FLR,并把握停药后的合适手术时机。
六、合并癌栓:手术禁区被重新划定
1. 门静脉/肝静脉癌栓:不再是绝对禁忌
可考虑手术:若癌栓能被连同肿瘤一并彻底切除,且患者能耐受手术。
位置关键:癌栓位于门静脉肝段分支,手术疗效相对较好;位于主干则争议大,可优先考虑转化治疗。
术后必须:辅以抗肿瘤综合治疗。
2. 下腔静脉/右心房癌栓:极度高危,谨慎前行
手术风险极大,预后极差。共识强烈建议先行转化治疗,创造手术条件。
3. 胆管癌栓:解除梗阻+去除病灶
治疗核心是切除原发灶并解除胆道梗阻。根据癌栓位置,可选择肝段切除+胆管切除或胆管切开取栓。
七、局部消融:小肝癌的微创利器
最佳适应人群:
≤3.0 cm 的小肝癌,在保证 0.5 cm「安全边缘」前提下,效果可媲美手术。
3.1~5.0 cm 的肿瘤,仅在肝功能差、无法耐受切除时考虑,或联合 TACE。
肝脏深部或中央型的小肝癌(尤其 ≤2.0 cm),为避免损失大量正常肝组织,可首选消融。
重要应用场景:
术中:对切缘可疑残留或发现的子灶进行 「补救性」 消融。
腹腔镜下:适用于经皮路径困难、邻近膈肌、胃肠、胆囊等危险部位的肿瘤。
八、合并肝硬化门脉高压:可联合脾切除
我国约 85%-90% 的肝癌患者合并肝硬化,其中约 30% 伴有脾功能亢进。
共识推荐,在切除肝癌原发灶的同时,以下情况可联合脾切除:
明确脾亢:白细胞 <3×10⁹/L,血小板 <50×10⁹/L。
预防出血:有食管胃底静脉曲张出血史者,可加做贲门周围血管离断术。
严重胃病:若情况允许,可考虑脾肾分流术等。
价值:脾切除不仅能改善血象、凝血功能和门脉压力,还能解除脾脏的免疫抑制状态,为术后接受 TACE 等后续治疗创造条件。
九、腹腔镜与机器人手术:技术成熟,应用拓展
微创肝切除的适应证已与开腹手术非常接近,但共识建议应量力而行。
初学者:建议从肿瘤 ≤5 cm、位于 Couinaud 分段第 2-6 段的病例开始。
经验丰富者:可挑战巨大肝癌、ALPPS(联合肝脏离断和门静脉结扎的二步肝切除术) 等复杂手术。
关键技术:腹腔镜超声和 ICG(吲哚菁绿)荧光成像是确保手术精准、安全的 「 左膀右臂 」。
十、肝移植标准:米兰标准仍是基石
米兰标准(国际金标准):单发 ≤5 cm,或瘤灶 ≤3 个且每个 ≤3 cm。
UCSF 标准(美国加州大学旧金山分校标准):单发 ≤6.5 cm,或瘤灶 ≤3 个且最大 ≤4.5 cm、总直径 ≤8 cm。
中国标准(如上海复旦标准、杭州标准):基于国情的扩展标准,适度扩大了受益人群,但其远期疗效仍需更多数据支持。
等待期管理:符合移植条件的患者在等待供肝期间,应接受桥接治疗以控制肿瘤进展。
十一、总结与决策路径:迈向多学科协作(MDT)时代
2025 版共识的核心精神是个体化、精准化与综合化。外科医生手中的 「 武器 」 越来越多,但选择也愈发复杂。最终决策必须根植于对患者肝功能和肿瘤生物学行为的深刻理解。
为帮助您快速梳理临床决策思路,我们将本共识的精髓凝练成以下路径图:
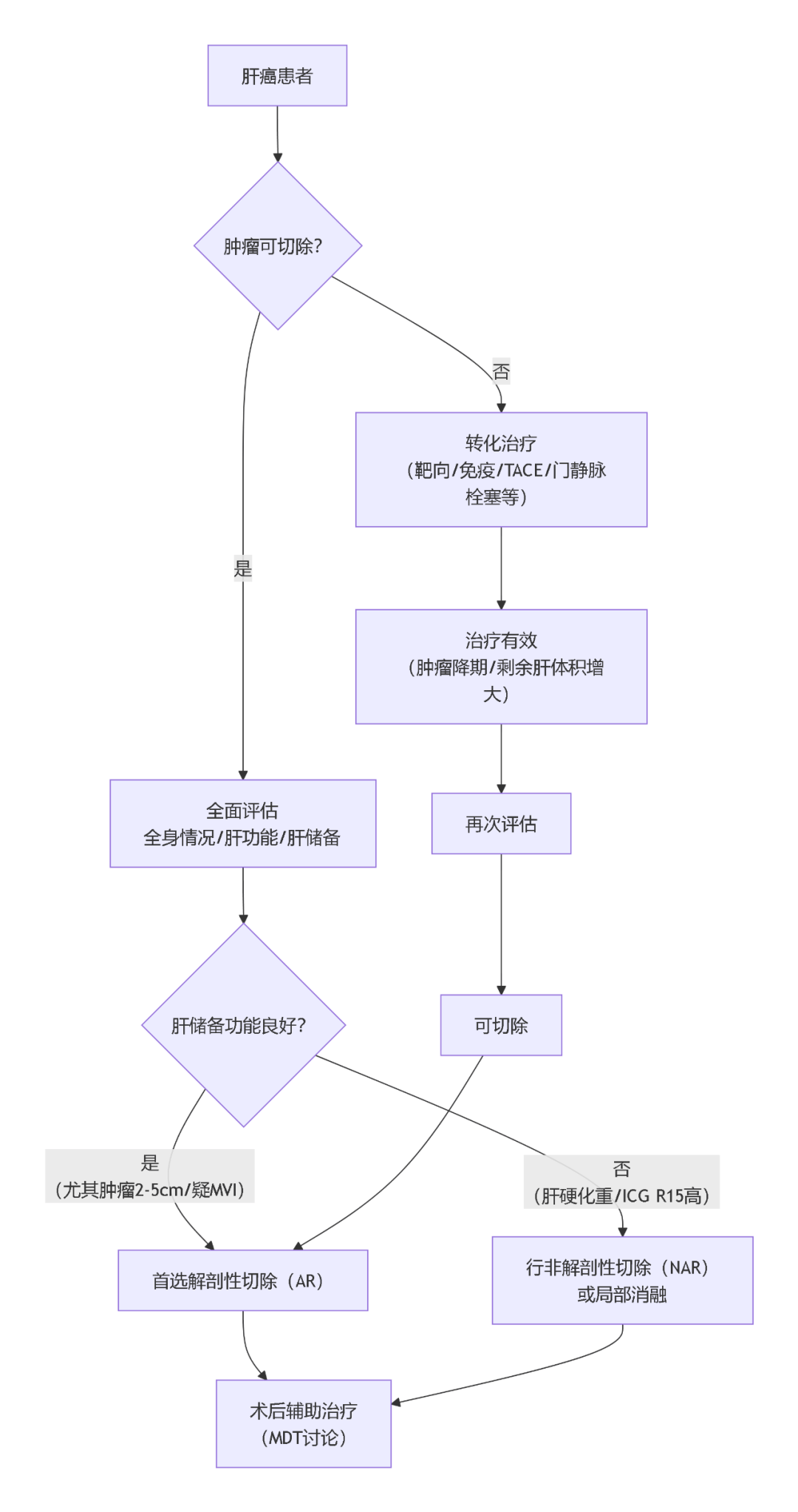
(图 1 肝癌外科手术临床决策路径图)
外科医生应作为多学科团队(MDT) 的核心,协同运用手术、消融、介入、靶向、免疫等多种手段,将上述决策路径灵活应用于每一位患者,才能真正实现疗效最大化。
首发:丁香园普外时间
题图:站酷海洛
投稿:gulujun@dxy.cn
参考文献
中华医学会外科学分会肝脏外科学组. 肝细胞癌外科治疗方法的选择专家共识(第 4 次修订)[J]. 腹部外科,2025, 38(5): 331-339.





