伴有腹膜转移(PD)的胃癌预后不良,治疗选择有限。FGFR2b靶向治疗已成为FGFR2b阳性肿瘤的潜在治疗方案。然而,FGFR2b在PD中的表达及扩增状态尚未明确。本研究旨在探讨胃癌患者配对原发肿瘤与PD组织中FGFR2b的表达及基因扩增情况,并评估其与已确立的生物标志物(包括HER2、CLDN18和PD-L1)的关联性。
对84例患者的配对原发肿瘤及PD组织进行FGFR2b免疫组织化学(IHC)检测,对IHC阳性病例进一步行FGFR2荧光原位杂交(FISH)检测。结果显示,7.1%(6/84)的原发肿瘤和4.8%(4/84)的PD样本中检测到FGFR2b表达。表达具有高度异质性;仅1例患者的原发肿瘤和PD组织均为FGFR2b阳性。10例IHC阳性样本中,6例存在FGFR2扩增,而IHC阴性样本中未检测到FGFR2扩增。FGFR2b状态与HER2、CLDN18或PD-L1无显著相关性。胃癌中FGFR2b的表达具有空间异质性,且在原发肿瘤与PD之间存在不一致性。若条件允许,建议同时检测原发肿瘤和PD组织,以更准确地筛选出适合FGFR2b靶向治疗的患者。对于缺乏其他生物标志物表达的PD阳性胃癌亚群,FGFR2b可能是一个潜在的治疗靶点。
研究背景
胃癌是全球第五大癌症相关死亡原因。晚期胃癌患者,尤其是伴有腹膜转移(PD)的患者,预后极差。不可切除或复发性胃癌的标准治疗方案包括化疗、抗HER2治疗(如曲妥珠单抗)、抗VEGFR2治疗(如雷莫芦单抗)以及免疫检查点抑制剂。近年来,抗Claudin 18.2抗体佐妥昔单抗,也被纳入治疗选择范畴。PD阳性胃癌通常表现为弥漫型组织学特征,且该亚型多为HER2阴性。与微卫星不稳定型和EB病毒阳性亚型相比,该亚型的PD-L1表达水平也相对较低。先前的研究显示,PD阳性胃癌中,仅28%的原发肿瘤和20%的PD组织呈CLDN18阳性,这凸显了寻找替代治疗靶点的必要性。
贝玛妥珠单抗是一种针对成纤维细胞生长因子受体2b(FGFR2b)的单克隆抗体,在一项随机Ⅱ期临床试验(FIGHT试验,NCT03694522)中,其联合化疗治疗HER2阴性、FGFR2b阳性晚期胃癌显示出良好疗效。在FIGHT试验的最终分析中,FGFR2b阳性被定义为≥10%的肿瘤细胞呈现中度或强阳性膜染色。这一定义在正在进行的Ⅲ期FORTITUDE试验(FORTITUDE-101,NCT05052801;FORTITUDE-102,NCT05111626)中沿用。
尽管已有少数研究报道对比了原发肿瘤与转移灶中FGFR2b的表达模式,但目前尚无针对PD中FGFR2b表达的专项研究。鉴于其临床重要性及相关数据的缺乏,本研究检测了PD阳性胃癌患者的原发肿瘤、PD组织及淋巴结转移灶中FGFR2b的表达情况,并采用FISH技术评估FGFR2b阳性病例的FGFR2扩增状态。此外,研究者还分析了FGFR2b状态与其他生物标志物(包括HER2、PD-L1和CLDN18)的关联性。
对FGFR2b 的膜染色(克隆号mFR2-10b)进行强度评分(0 = 无染色,1+= 弱阳性,2+= 中度阳性,3+= 强阳性)和阳性肿瘤细胞百分比评分。经确认存在 FGFR2 扩增且呈强表达(3+)的胃癌组织用作 3 + 阳性对照。参照正在进行的 Ⅲ 期临床试验的入选标准,FGFR2b 阳性定义为≥10%的肿瘤细胞呈现中度(2+)或强阳性(3+)膜染色。HER2采用兔单克隆抗HER2抗体(克隆号4B5)进行IHC检测。PD-L1采用克隆号SP263进行IHC检测。CLDN18采用克隆号43-14A进行IHC检测,CLDN18阳性定义为≥75%的肿瘤细胞呈现中度(2+)或强阳性(3+)染色。
研究结果
原发肿瘤中FGFR2b状态及其与临床病理特征的相关性:
图1A-H展示了各FGFR2b染色强度评分的代表性免疫组织化学图像。在84例胃癌原发肿瘤中,6例(7.1%)检测到FGFR2b阳性表达(表1)。FGFR2b状态与患者性别、年龄及肿瘤位置无显著相关性。组织学类型方面,66例(78.6%)为弥漫型,18例(21.4%)为肠型,不同组织学亚型间FGFR2b表达无显著差异。
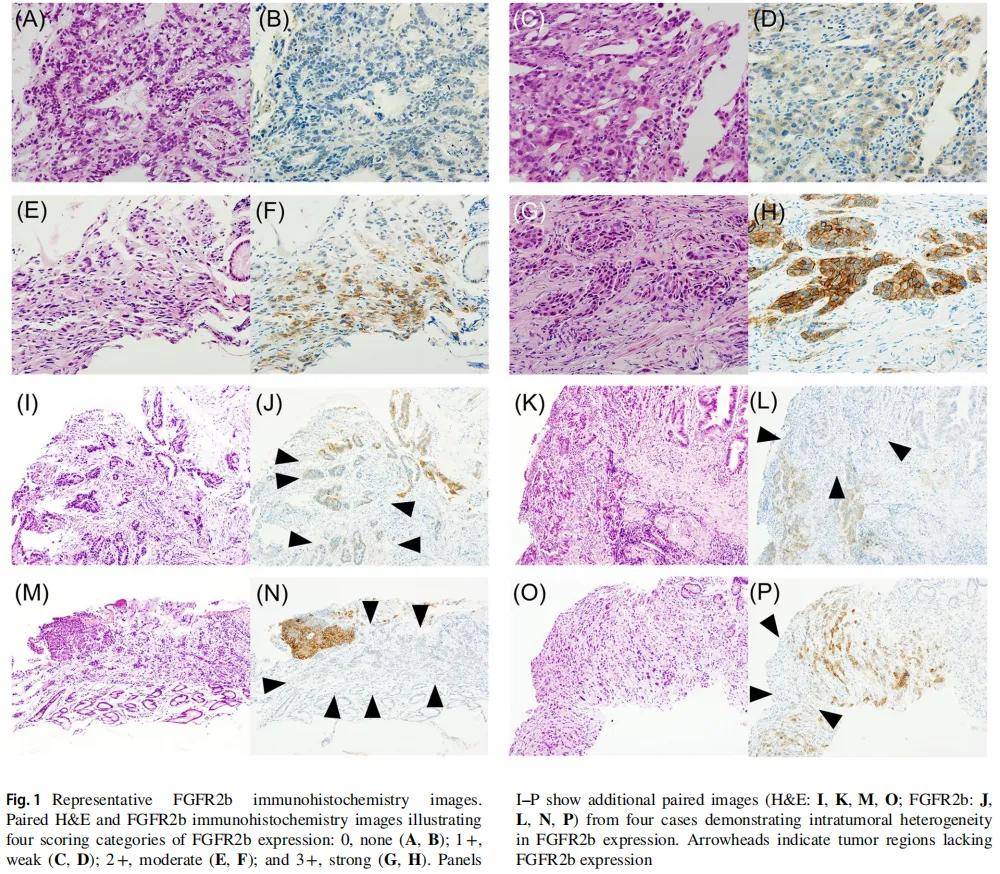
图1
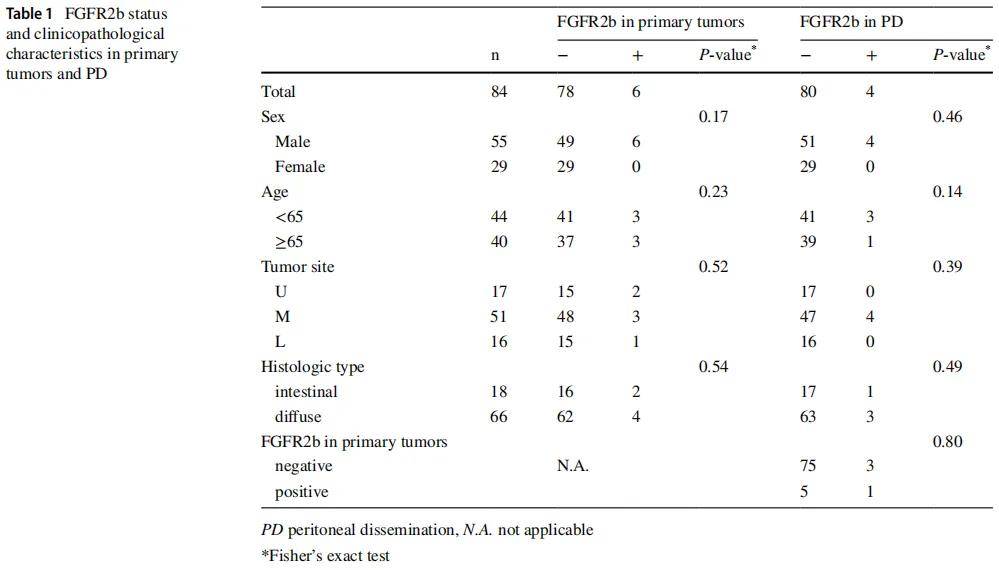
表1
Kaplan-Meier分析显示,FGFR2b阳性与阴性肿瘤患者的总生存期(OS)无显著差异(图2A)。
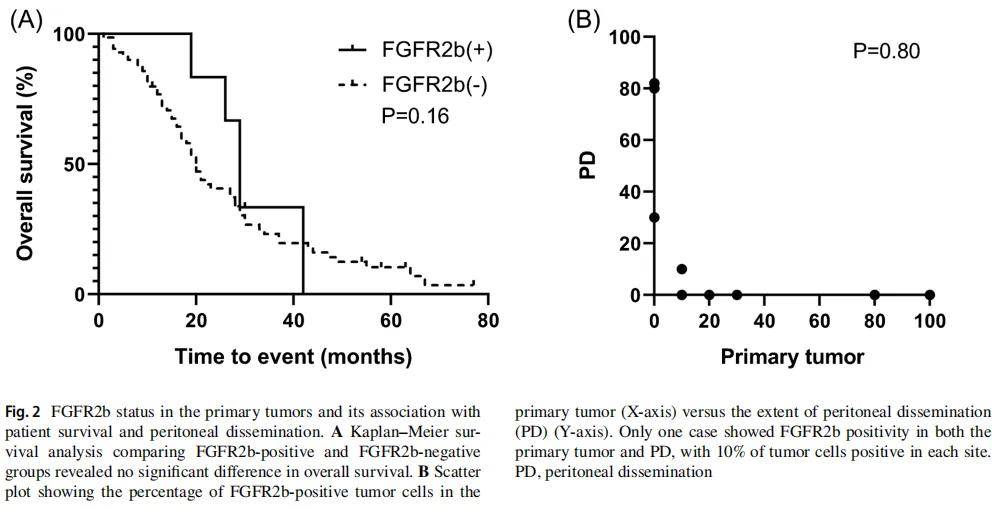
图2
6例FGFR2b阳性活检标本中,4例存在明显的肿瘤内异质性(图1I-P)。仅1例手术切除的原发肿瘤为FGFR2b阳性,该肿瘤虽已弥漫浸润胃壁全层,但FGFR2b表达仅局限于肿瘤边缘黏膜下层约10%的癌细胞中。
原发肿瘤、PD及淋巴结转移灶中FGFR2b表达的对比:
84例PD样本中,4例(4.8%)检测到FGFR2b表达(图2B及表1),其表达与患者年龄、性别及肿瘤位置无显著相关性。在原发肿瘤或PD中任一部位FGFR2b阳性的9例患者中,仅1例(1.2%)两个部位均为阳性。
6例原发肿瘤FGFR2b阳性的患者中,仅1例(16.7%)的PD组织同时表达FGFR2b;而78例原发肿瘤FGFR2b阴性的患者中,75例(96.2%)的PD组织也为阴性。
28例淋巴结转移标本中,6例(21.4%)检测到FGFR2b表达。3例原发肿瘤FGFR2b阳性的患者,其淋巴结转移灶均为FGFR2b阳性;25例原发肿瘤FGFR2b阴性的患者中,22例(88%)的淋巴结转移灶也为阴性。
FGFR2基因扩增及其与FGFR2b表达的相关性:
图3A-F展示了FGFR2b免疫组织化学与FGFR2 FISH检测的代表性图像。在原发肿瘤或PD中任一部位FGFR2b表达阳性的9例患者中,10份组织标本(6份原发肿瘤、4份PD样本)为FGFR2b阳性,8份为阴性(3份原发肿瘤、5份PD样本)。对所有18份标本均进行了FISH检测(图3G)。
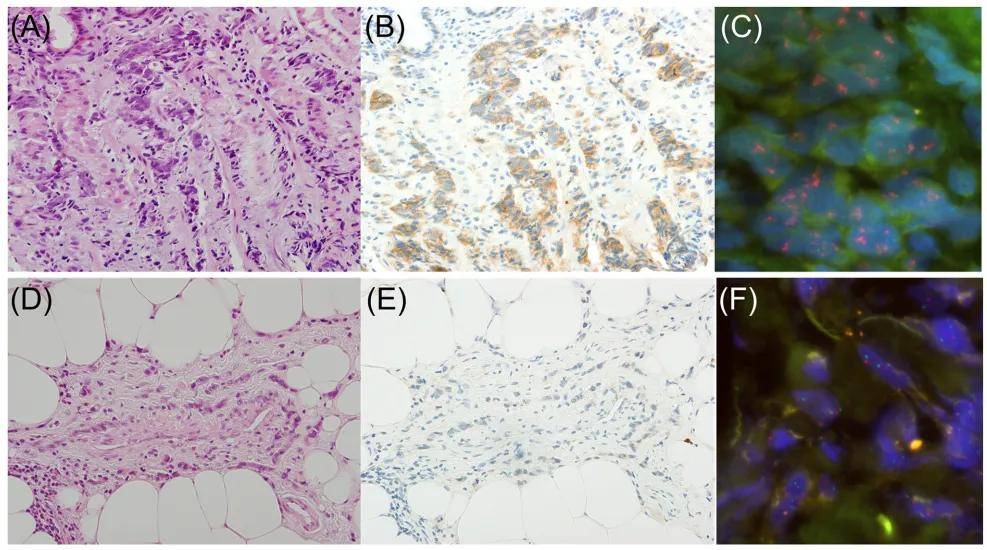
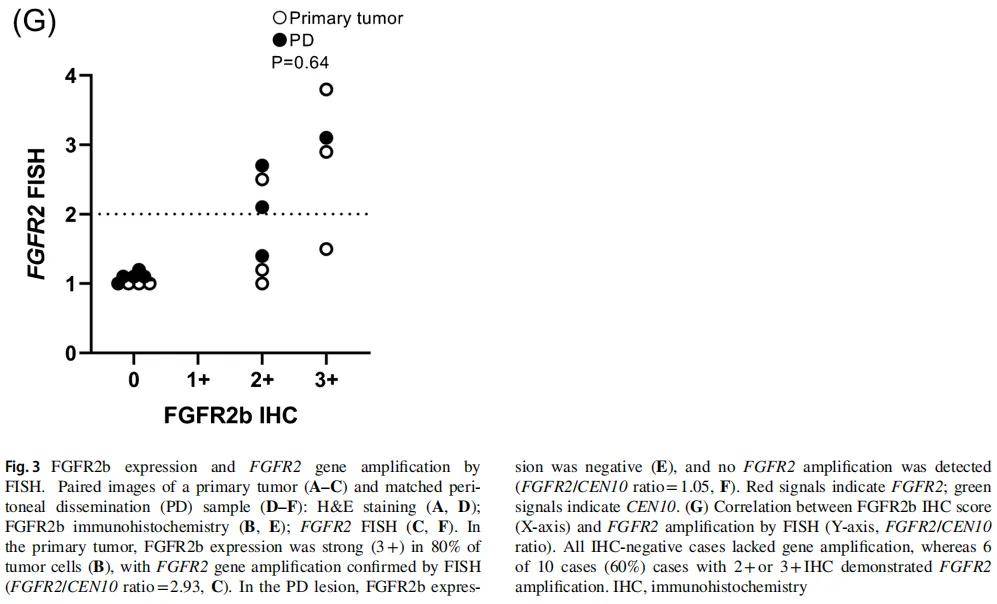
图3
所有FGFR2b阴性的标本均未检测到FGFR2扩增;10例FGFR2b阳性标本中,6例(60%)存在FGFR2扩增。具体为6例2+染色标本中3例(50%)扩增,4例3+染色标本中3例(75%)扩增。
在存在肿瘤内异质性的肿瘤中,FGFR2扩增仅局限于FGFR2b阳性区域。6例FGFR2b阳性细胞比例≥30%的肿瘤均表现出基因扩增,而3例阳性细胞比例<30%的肿瘤均无扩增。
FGFR2b与其他生物标志物(CLDN18、HER2、PD-L1)的相关性:
将FGFR2b表达数据与同一队列中先前报道的HER2、PD-L1及CLDN18检测结果进行整合分析(图4)。84例患者中,10例(11.9%)HER2阳性,其中肠型肿瘤6/18例(33.3%)、弥漫型肿瘤4/66例(6.1%);26例(31.0%)PD-L1综合阳性评分(CPS)≥5,20例(23.8%)1≤CPS<5,38例(45.2%)CPS<1;24例(28.6%)CLDN18阳性(≥75%阳性细胞)。
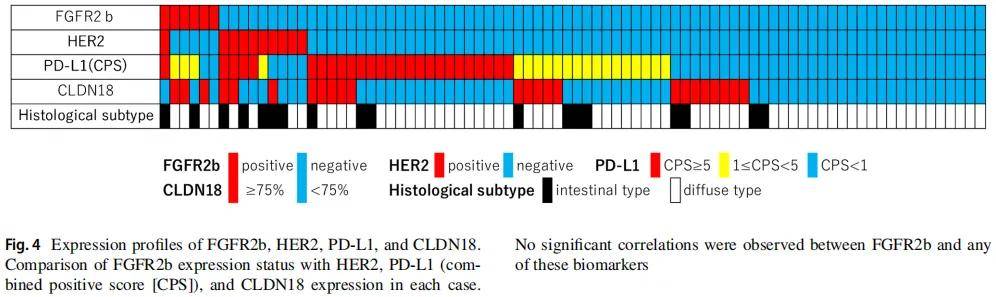
图4
FGFR2b表达与HER2、PD-L1及CLDN18表达均无显著相关性。总体而言,84例肿瘤中60例(71.4%)至少表达上述一种治疗靶点;1例患者仅FGFR2b阳性,HER2、PD-L1及CLDN18均为阴性。
讨 论
本研究显示,PD阳性胃癌中,原发肿瘤的FGFR2b阳性率为7.1%,PD病灶的阳性率为4.8%。这些比率低于FIGHT试验中报道的18%的原发肿瘤阳性率。然而,Lee等人近期开展的一项大规模研究采用与FIGHT试验相同的抗体克隆(FPR2-D)和临界值标准,报道胃癌中FGFR2b过表达率为4.1%。因此,FGFR2b阳性率的差异并非仅由所用抗体不同导致,还可能受到队列差异的影响。
本研究首次专门聚焦PD病灶评估FGFR2b表达情况,结果显示仅1例患者的原发肿瘤和PD均为FGFR2b阳性,提示两者一致性较低。类似地,Lee等人报道135例配对的原发肿瘤与转移灶标本中,仅1例(0.7%)存在一致性。有趣的是,28例患者中25例(89%)的原发肿瘤与淋巴结转移灶FGFR2b状态一致,表明FGFR2b表达在淋巴结转移灶中可能比在PD中更易保留。这些发现提示,FGFR2b过表达可能出现于肿瘤亚克隆群体中,且在不同转移部位的维持情况存在差异,这也是导致空间异质性的原因之一。
多种机制可能解释原发肿瘤与PD病灶间的FGFR2b状态不一致:FGFR2b阳性克隆可能无法发生转移,或者在转移过程中获得了基因扩增和过表达。值得注意的是,部分PD病灶虽起源于FGFR2b阴性的原发肿瘤,但其自身为FGFR2b阳性,这凸显了直接评估PD组织的重要性。与此一致,Lee等人也发现活检标本检测FGFR2b表达的敏感性较低,仅1对活检-手术标本(0.6%)存在状态一致性。这些观察结果表明,在考虑使用贝玛妥珠单抗等FGFR2b靶向治疗时,同时检测原发灶和转移灶具有重要临床意义。
本研究还探讨了FGFR2b表达与FGFR2基因扩增的关系。结果显示,60%的FGFR2b IHC阳性肿瘤标本存在FGFR2扩增,而所有IHC阴性标本均无扩增。与本研究发现一致,一项早期研究报道94.1%的FGFR2b过表达肿瘤存在扩增,而FGFR2b阴性病例均无扩增。既往文献报道FGFR2b表达阳性率为4%-28%,FGFR2扩增率为2%-9%,扩增率等于或低于FGFR2b表达阳性率。这些结果表明,FGFR2b IHC是评估FGFR2扩增的可靠替代标志物,足以用于筛选适合接受FGFR2抑制剂治疗的胃癌患者。
值得注意的是,本研究未发现FGFR2b表达与HER2、CLDN18或PD-L1等其他生物标志物存在显著相关性。这与既往研究结果一致,即FGFR2b与其他可作用生物标志物无明显重叠。重要的是,本研究中有1例患者仅FGFR2b阳性,提示其可能在生物标志物阴性胃癌中构成一个独立的治疗靶点亚群。
本研究存在局限性:首先,这是一项单中心回顾性研究,由于临床实践中PD很少接受手术切除,导致样本量相对较小;此外,本研究中大多数原发肿瘤的FGFR2b状态通过活检标本评估,受样本量小和FGFR2b表达的肿瘤内异质性影响,原发肿瘤的阳性率可能被低估。其次,由于研究开始时无法获得临床试验中使用的FPR2-D克隆抗体,研究者采用了mFR2-10b克隆抗体,非FIGHT试验用抗体可能影响阳性率,从而限制了与其他研究的可比性。不过,尽管尚无研究直接比较FPR2-D和mFR2-10b,一项使用FIGHT试验抗体的研究报道了相近的FGFR2b阳性率。此外,由于FGFR2b阳性病例总体发生率较低,本研究的生存分析及其他临床病理分析的统计效能不足。尽管如此,本研究首次专门探讨PD中的FGFR2b状态,强调了空间异质性的关键作用,具有独特价值。
总之,据研究者所知,本研究是首个针对一系列PD阳性胃癌评估FGFR2b状态的研究,尤其聚焦于原发肿瘤与PD组织的对比分析。鉴于FGFR2b表达在原发肿瘤与PD之间存在空间异质性且一致性较低,同时检测两个部位的FGFR2b状态可能有助于更精准地筛选适合FGFR2b靶向治疗的患者。
参考文献:
Ogawa, Haruki et al. “Spatial heterogeneity of FGFR2b in gastric cancer: a comparative analysis of primary tumors and peritoneal dissemination.” Virchows Archiv : an international journal of pathology, 10.1007/s00428-025-04233-z. 30 Aug. 2025, doi:10.1007/s00428-025-04233-z





