左半结肠癌根治术主要用于治疗脾曲结肠癌、降结肠癌和乙状结肠癌,其中脾曲结肠癌和降结肠癌发病率较低,但随着治疗技术的发展,其预后得到不断提高。目前,非转移性左半结肠癌根治术的术后肿瘤学预后略优于右半结肠癌。脾曲结肠的血管供应存在变异,包括肠系膜上动脉系统和肠系膜下动脉系统来源的动脉,且其解剖位置特殊,淋巴引流复杂,导致手术范围存在争议。近年来研究发现,遵循“10 cm”原则进行左半结肠癌肠管切除是合理的,且最小范围的脾曲结肠切除已足够,其淋巴结清扫范围可根据分站阳性率来确定,其中第253组淋巴结无需清扫。但当副结肠中动脉存在时,应将其作为D 3清扫的主要供血血管。此外,左半结肠相关膜解剖研究进展,为脾曲结肠癌的左半结肠癌手术提供了新视角,基于膜解剖的囊外法游离可安全高效地完成脾曲结肠游离。
左半结肠癌根治术主要用于治疗脾曲结肠癌、降结肠癌和乙状结肠癌。其中,脾曲结肠癌和降结肠癌发病率较低。回顾早年我中心关于2 641例非转移性结直肠癌的预后研究,脾曲结肠癌仅占2.0%,降结肠癌占4.3%,乙状结肠癌占28.5% [ 1 ] 。根据最新国际结肠的肠段定义共识,脾曲结肠癌定义为横结肠远端与降结肠近端相交处(转角)两侧各10 cm范围内的结肠癌,不再描述“横结肠近脾曲癌”和“降结肠近脾曲癌”等术语[ 2 ] 。传统观点认为,左半结肠癌的肿瘤学预后劣于右半结肠癌,特别是脾曲结肠癌的肠梗阻风险最高(49%),围手术期病死率最高(18%),即使进行了根治性切除,患者5年生存率也仅为38%[ 3 ] 。随着全身抗肿瘤治疗和外科技术的不断发展,左半结肠癌的预后不断得到提高[ 4 ] 。笔者课题组基于“监测、流行病学与最终结果(Surveillance,Epidemiology,and End Results,SEER)”数据库进行的一项人口学研究,也发现脾曲癌根治术的12枚淋巴结清扫达标率从2013年至2022年提升了近50%[ 5 ] 。大宗人口学研究已证实,目前非转移性左半结肠癌根治术的术后肿瘤学预后略优于右半结肠癌(HR=1.12)[ 6 ] 。
目前,降结肠癌和乙状结肠癌根治术的手术范围较成熟,而脾曲结肠癌因其解剖学位置特殊、血供来源和淋巴引流较复杂,其根治术范围仍存在争议。脾曲结肠的血供来源包括:肠系膜上动脉(superior mesenteric artery,SMA)系统来源的结肠中动脉左支和(或)副结肠中动脉(accessory middle colic artery,aMCA)以及肠系膜下动脉(inferior mesenteric artery,IMA)系统来源的左结肠动脉(left colic artery,LCA) [ 7 ] 。值得注意的是,目前认为,脾曲结肠癌的淋巴引流并非仅沿着上述供血动脉分布,还存在着肠系膜下静脉(inferior mesenteric vein,IMV)或胰腺下缘途径[ 8 ] 。此外,脾曲结肠位于中肠和后肠的交界,膜解剖结构复杂,近年来关于其解剖学研究较少。笔者8年前曾对左半结肠切除术的争议和基于膜解剖的脾曲游离技巧进行阐述[ 9 ] 。近年来,本中心对左半结肠癌(主要是脾曲结肠癌)相关淋巴结清扫范围、术式和膜解剖又进行了一系列探索和更新,本文拟对上述议题的研究进展进行复习,并结合本中心系列研究经验进行明晰和阐述。
一、 脾曲结肠的血管供应变异
1.肠系膜上动脉(SMA)系统——传统观点和aMCA的解剖学变异:主要包括结肠中动脉(middle coic artery,MCA)和(或)aMCA。MCA为术者所熟知,为传统脾曲癌D 3站清扫的主要供血血管(占90.9%),常分为右支和左支,其中左支为脾曲结肠供血。值得注意的是,约9.1%的右支和左支分别起源于SMA[ 10 ] 。
aMCA的经典走行是在MCA发出点近端约3 cm处起自SMA,行走于胰腺下缘,跨过Treitz韧带并被十二指肠上皱襞覆盖,在该区域穿过IMV,最终供应结肠脾曲 [ 11 ] ( 图1 )。一项解剖学Meta分析发现,aMCA的平均发生率为25.4%(6.8%~49.2%),当LCA缺如时,aMCA发生率升高可达86.4%,提示aMCA和LCA存在互补性。此外,在23.1%的病例中,aMCA还发出胰腺支至胰腺[ 12 ] 。aMCA最常见的起源部位是SMA(87.9%)。其他较少见的起源部位包括腹腔干(3.6%)、背胰动脉(2.1%)、肝总动脉(1.9%)和空肠动脉(1.7%)等[ 12 ] 。
展开阅读
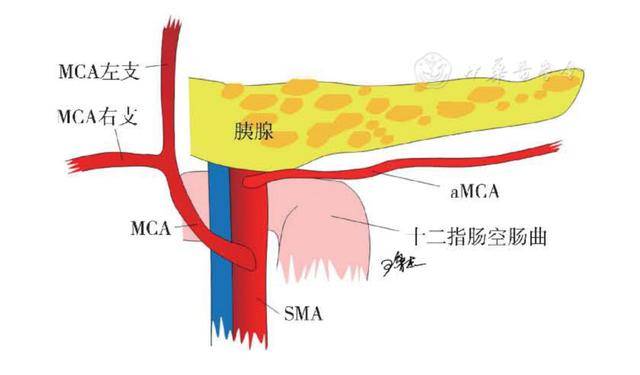
图1 副结肠中动脉(aMCA)的起源和走行示意图(王枭杰绘制)
注:MCA:结肠中动脉;SMA:肠系膜上动脉;aMCA:副结肠中动脉
2.肠系膜下动脉(IMA)系统——左结肠动脉(LCA):LCA为术者所熟知,其发出点距离IMA根部约4 cm,最新的Meta分析提示,其缺如率仅1.2% [ 13 ] 。目前,关于LCA解剖变异的分型类别繁杂,从实用角度出发,基于腹腔镜视野,常把LCA分为3型:A型,LCA从IMA单独发出(占46.4%);B型,LCA和第1支乙状结肠动脉(sigmoid arteries,SA)共干(占23.6%);C型,LCA和SA并行发出(占30.0%)[ 14 ] ( 图2 )。
展开阅读
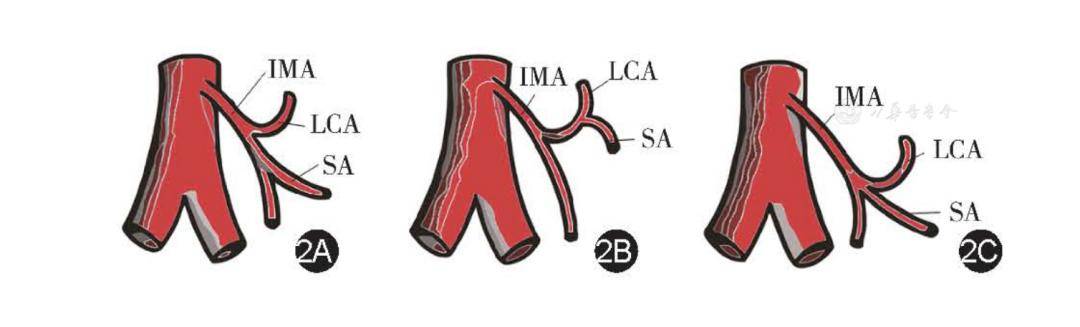
图2 左结肠动脉(LCA)分型示意图(王枭杰根据参考文献[ 13 ]绘制)2A.A型,LCA从IMA单独发出(占46.4%);2B.B型,LCA和第1支SA共干(占23.6%);2C.C型,LCA和SA并行发出(占30.0%)
注:IMA:肠系膜下动脉;LCA:左结肠动脉;SA:第1支乙状结肠动脉
3.脾曲结肠供血动脉的组成分型:鉴于脾曲结肠各动脉来源变异较多,Tanaka等 [ 10 ] 基于术前三维CT重建结果,将脾曲结肠血供来源的组成分为4型:1型,由MCA左支和LCA供血,占54.5%;2型,由直接起自SMA的MCA左支和LCA供血,占9.1%;3型,由aMCA和LCA供血,占30.7%;4型,由LCA单独供血,占比5.7%( 图3 )。理解以上供血方式有助于理解脾曲结肠癌的淋巴结清扫范围。
展开阅读
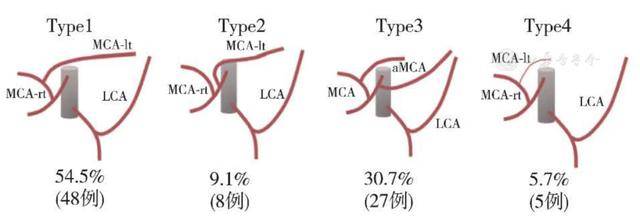
图3 脾曲结肠供血动脉的组成分型 [ 10 ]
注:MCA-lt:MCA左支;MCA-rt:MCA右支;LCA:左结肠动脉;aMCA:副结肠中动脉
4. 左结肠动脉(LCA)和肠系膜下静脉(IMV)在胰腺下缘的相对位置:LCA在胰腺下缘常与IMV伴行一段距离。Patroni等 [ 15 ] 发现,在胰腺下缘,LCA与IMV距离2 cm者占66%。Miyake等[ 16 ] 纳入734例结直肠癌病例,对该区域的局部解剖关系进行了更系统地研究,发现有25.5%的LCA位于IMV稍内侧,40.3%位于稍外侧,29.6%位于距离IMV较远的外侧,4.6%的LCA缺如( 图4 )。
展开阅读
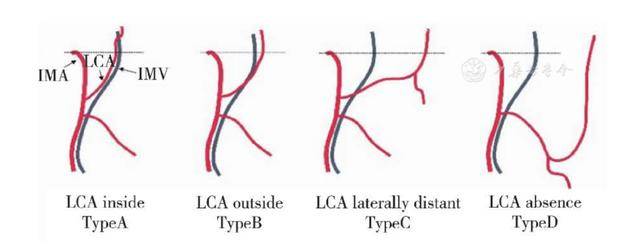
图4 LCA和IMV在胰腺下缘的相对位置 [ 16 ]
注:IMA:肠系膜下动脉;IMV:肠系膜下静脉;LCA:左结肠动脉
二、 左半结肠癌肠管切除范围证据更新
主要争议点在于脾曲结肠癌。目前,关于其术式的命名较为混乱,笔者之前的述评曾介绍日本著作中左半结肠切除术的切除范围及命名,包括段结肠切除术(仅结扎LCA)、左半结肠切除术(同时结扎LCA和SA)和扩大左半结肠切除(同时结扎SA、LCA以及MCA左支) [ 9 ] 。但目前文献中关于各术式的定义需具体结扎的血管仍存在诸多差异,为临床各术式的具体实践和预后研究带来了混乱[ 17 ] 。近年来,在笔者的临床实践中发现,左半结肠癌因肿瘤位置变化区间较大,术中应基于肿瘤的具体位置决定肠管切除范围,而非教条地套用结扎血管。目前,国际上主流的脾曲癌术式的切除范围由小到大包括:脾曲结肠切除、左半结肠切除、扩大右半结肠切除和次全结肠切除术。一项针对大不列颠及爱尔兰结直肠外科协会(Association of Coloproctology of Great Britain and Ireland,ACPGBI)成员的匿名实践调查表明,63%的受访者倾向于选择扩大右半结肠切除治疗脾曲癌[ 18 ] ;而一项法国的多中心调查则显示,脾曲结肠切除是该调查中用于治疗脾曲癌的最主流术式(70%)[ 19 ] 。笔者团队曾针对上述4种术式进行网状Meta分析,共纳入2 734例脾曲癌患者,结果显示,4种术式治疗脾曲癌的近期预后(吻合口漏和再手术率)与远期肿瘤学预后(局部复发率和远处转移率)相近,但脾曲结肠切除术后肠麻痹发生率最低[ 20 ] 。该研究被国际脾曲结肠癌定义和外科管理共识所引用,并作为支持脾曲结肠切除治疗脾曲癌的依据(一致率:72%)[ 21 ] 。此外,笔者基于SEER数据库对10 063例非转移性脾曲癌的术式进行预后分析发现,相对于左段结肠切除(4 517例),扩大结肠切除范围(包括左半结肠切除、扩大右半结肠切除和结肠次全切除,5 546例)并不带来额外的肿瘤学获益,即便是对于肿瘤TNM分期为Ⅲ期亚组及肿瘤>7 cm的局部进展期亚组,左段结肠切除与左半结肠切除的肿瘤特异性生存率(cancer-specific survival,CSS)和总体生存率(overall survival,OS)差异亦无统计学意义[ 5 ] 。此外,扩大结肠切除虽然增加了淋巴结拣获数(14.4枚比12.7枚,PP=0.90)[ 5 ] 。笔者团队分析本中心2011—2018年间接受脾曲结肠切除、左半结肠切除和扩大左半结肠切除的117脾曲结肠癌患者的数据,发现3种术式的5年OS(94.0%比90.2%比94.1%)和5年无病生存率(disease-free survival,DFS,88.2%比90.2%比83.0%)差异亦无统计学意义[ 22 ] 。以上研究均提示,最小范围的脾曲结肠切除治疗脾曲癌已足够。
从具体肠管切除长度来看,无论是脾曲结肠癌、降结肠癌或乙状结肠癌,传统的“10 cm+5 cm”肠管切除原则的临床证据有限,扩大肠管切除范围旨在彻底清扫所切除肠段的肠旁和边缘弓淋巴结。然而,近年发表的日本多中心前瞻性研究,纳入日本25个中心的2 996例Ⅰ~Ⅲ期结肠癌患者,于术中对肠管切除范围进行距离定位,结果发现,仅0.1%出现距离肿瘤边缘>10 cm处的肠旁淋巴结转移,且肿瘤与供血动脉之间的距离并不存在特定的转移淋巴结分布模式;左半结肠癌方面,该研究同时设置了脾曲癌、横结肠癌和降结肠癌亚组,发现这3个部位结肠癌>10 cm的肠旁淋巴结转移率均为0,而乙状结肠癌>10 cm的肠旁淋巴结转移率仅0.3% [ 23 ] 。故可遵循“10 cm”原则进行左半结肠癌肠管切除。
三、 基于分站阳性率理解左半结肠癌淋巴结清扫范围
近年来,中日指南关于结肠癌淋巴结清扫范围总体原则的描述并无改变。根据《中国结直肠癌诊疗规范(2023版)》,对于结肠癌,当肿瘤为T1N0M0、且具有预后良好的组织学特征(如分化程度良好或无脉管浸润)时,建议局部切除;当T2~4N0~2M0时,建议首选的手术方式是相应结肠切除联合区域淋巴结清扫,区域淋巴结清扫必须包括肠旁、中间和系膜根部淋巴结(即D 3清扫)[ 24 ] 。《日本结直肠癌学会2019年结直肠癌治疗指南》则推荐T1N0行D2手术,T2N0行D2或D3手术,T3N0或N+均行D3手术[ 25 ] 。
虽然结肠供血动脉和结肠癌肠旁淋巴结转移(即肠管水平方向)之间不存在相关性,但目前证据认为,供血动脉与结肠癌的距离越近,则其发生中间(或中央)淋巴结转移(即肠管垂直方向)的风险增加 [ 23 ] 。值得注意的是,主要供血动脉与原发肿瘤的距离因肿瘤位置而异。盲肠癌的供血动脉与肿瘤距离最近(平均2.0 cm),乙状结肠次之(2.8 cm),而脾曲癌与供血动脉的距离大于其他结肠段肿瘤(4.1 cm),故其发生中间(或中央)淋巴结转移率最低(11.8%),降结肠癌距离次之(3.8 cm),其中间(或中央)淋巴结转移率亦很低(16.7%)[ 23 ] 。
★




