【导读】射频消融术(RFA)已成为肝细胞癌(HCC)的一种关键治疗手段。
9月16日,温州医科大学研究团队在期刊《Advanced Science》上发表了研究论文,题为“Tumor-Targeted FABP5/STING Cascade Promote Radiofrequency Ablation Induced Ferroptosis and Intratumoral Immune Rewiring in Hepatocellular Carcinoma”,本研究中,本研究推出了一种新型纳米载体共递送系统,旨在靶向肝细胞癌(HCC)中的关键分子靶点,以增强铁死亡并重新编程肿瘤内免疫,从而改善射频消融(RFA)的治疗效果。通过使用共递送纳米载体靶向 FABP5 显著提高了 RFA 的疗效。此外,FABP5 缺失会增强射频消融(RFA)诱导的铁死亡,并增强抗肿瘤免疫反应,其特征是 CD8+ T 细胞和效应记忆 T 细胞浸润增加,从而显著增强全身抗肿瘤效果。从机制上讲,FABP5 抑制会激活 STING/TBK1 信号通路并调节 TBK1 蛋白质稳定性。值得注意的是,靶向 FABP5 的纳米载体系统会提高 PD-L1 表达,而 RFA 与抗 PD-L1 疗法的联合应用对肝细胞癌(HCC)显示出协同疗效。总之,靶向 FABP5 的纳米载体共递送系统为增强 RFA 在 HCC 中的有效性提供了一种有前景的策略,为临床治疗方法的改进提供了新的框架。

背景知识
01
原发性肝癌,主要是肝细胞癌(HCC),仍是全球癌症相关死亡的第四大原因。肝细胞癌的标准治疗方案包括手术切除、肝移植、局部消融疗法和射频消融。然而,大多数肝细胞癌患者在确诊时由于肝功能储备受损和疾病晚期,不符合根治性手术干预的条件。这种情况凸显了开发和验证针对不适合手术干预的晚期肝细胞癌患者的微创治疗方案的迫切需求。
靶向 FABP5 共递送系统联合射频消融和抗 PD-L1 可有效抑制肝癌进展
02
先前的研究表明,纳米载体介导的 FABP5 敲除可增强免疫治疗的效果。为了进一步验证 FABP5 敲除联合射频消融(RFA)在肝细胞癌(HCC)免疫治疗中的抗肿瘤效果,研究人员对 FABP5 对肿瘤微环境(TME)的影响进行了分析。与 FABP5 阴性组相比,FABP5 阳性组中增殖的 CD8+ T 细胞比例显著降低,这表明 FABP5 阴性队列具有更强的抗肿瘤免疫反应。这些发现与之前的结果一致,突出了 FABP5 下调的治疗益处。免疫组化显示,使用靶向 FABP5 共递送系统治疗后,PD-L1 表达显著增加,这表明双载纳米颗粒与 RFA 联合使用可增强 HCC 中抗 PD-L1 免疫治疗的效果。在肿瘤模型中给予抗 PD-L1 抗体显著增强了双载纳米颗粒的抑制作用,导致肿瘤重量、体积和生长率大幅降低。在整个实验期间未检测到明显的生物毒性,而且该治疗具有出色的生物相容性。这些结果表明,靶向肿瘤细胞内在的 FABP5 可促进射频消融诱导的铁死亡,并通过激活 STING/TBK1 通路和稳定 TBK1 蛋白来重塑肿瘤内免疫微环境。此外,将靶向 FABP5 的纳米载体共递送系统与射频消融和抗 PD-L1 单克隆抗体相结合,构成了一种有前景且有效的肝细胞癌治疗策略。
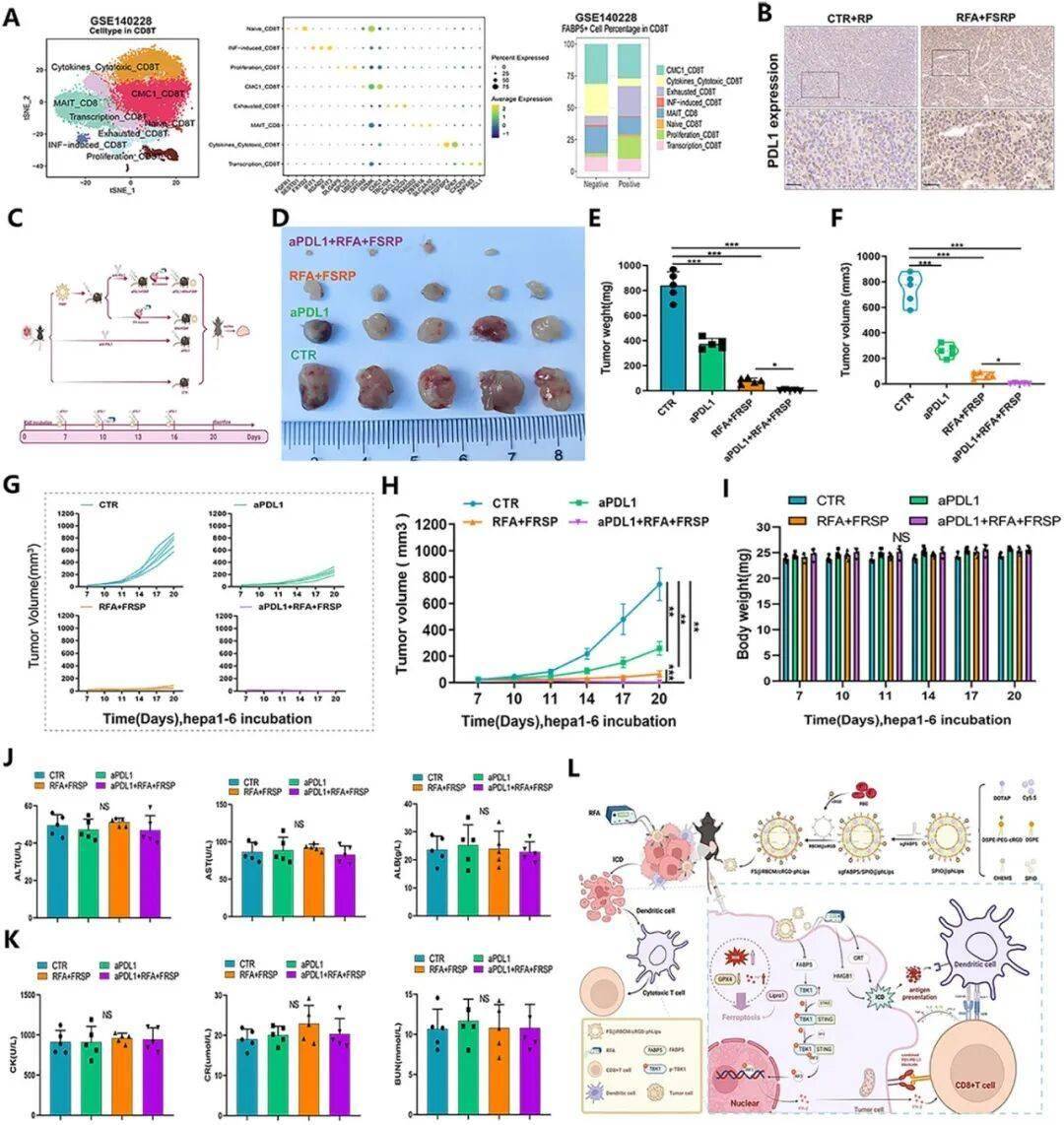
靶向 FABP5 共递送系统联合射频消融(RFA)和抗 PD-L1 疗法可有效抑制肝癌进展
结论
03
总之,本研究确定 FABP5 是肝细胞癌(HCC)的一个有前景的治疗靶点,其与射频消融(RFA)的疗效有很强的关联。研究人员开发了一种创新的双载纳米粒子系统(FS@RBCM/cRGD-phLips),将SPIO整合到 sgFABP5 中,以增强纳米粒子的靶向能力,并显著放大 RFA 的肿瘤破坏效果。这种治疗 HCC 的策略表现出卓越的疗效。这种将基因编辑技术、纳米技术和免疫疗法相结合的创新方法,不仅为癌症治疗提供了新颖有效的框架,而且具有重要的临床应用潜力。
参考资料:
【关于投稿】





