整理:肿瘤资讯
来源:肿瘤资讯
引言:前列腺癌是全球男性最常见的恶性肿瘤之一,其诊疗策略正经历着前所未有的飞速变革。随着外科技术迈向微创化、精准化与智能化,以及新型药物和治疗模式的不断涌现,前列腺癌的管理已从单一的手术或内分泌治疗,演进为以循证医学为基础、多学科协作的全程化管理模式。
在2025 CSCO年会期间,复旦大学附属肿瘤医院朱耀教授进行了题为“执锐攻坚:前列腺癌手术重塑生存格局“的深度讲题,从外科技术进步、围术期系统治疗探索及综合治疗拓展三大维度,深入剖析前列腺癌领域的最新进展。肿瘤资讯特此整理精华内容,进行报道。

朱耀
复旦大学附属肿瘤医院 泌尿外科 行政副主任 主任医师 教授 博士生导师
Journal of Clinical Oncology编委
Prostate Cancer and Prostatic Diseases编委、MDT Perspective专题负责人
国际泌尿资讯播客GUCast特约顾问
ESMO Asia学术委员会会员
中国抗癌协会青年理事会副理事长
中国临床肿瘤学会理事、前列腺癌专家委员会秘书长
上海东方英才计划拔尖人才、优秀学术带头人、高校特聘教授(东方学者)、“医苑新星”杰出青年医学人才
年完成前列腺癌根治术超过460台
作为课题负责人承担国家自然科学基金5项
一、前列腺癌外科技术进步与精准手术实现
朱耀教授在会中提到,前列腺癌外科手术在技术与理念上经历了深刻变革,逐步迈向微创化、智能化和精准化。其中,机器人辅助根治性前列腺切除术(RARP)已成为治疗局限性前列腺癌的重要方式,其在神经保留方面的优势显著,有助于术后性功能的恢复。多项研究显示,RARP尤其是双侧神经保留(NS)术式,在勃起功能恢复方面优于开放和腹腔镜手术1-3。
近年来,国产机器人手术系统日趋成熟,多项临床试验证实其安全性与有效性已达到与进口设备相当的水平4,5。在精准手术方面,双模式示踪剂技术(如68Ga-PSMA PET/CT联合荧光成像)的应用显著提高了术中病灶定位的准确性,为实现更彻底的切除提供了有力支持6。此外,人工智能技术也在术后风险评估中发挥重要作用,例如XGBoost预测模型在复发风险评估中表现出卓越性能(AUC=0.91),极大增强了术后管理的预见性7。值得关注的是,增强现实技术(AR-RARP)相较于标准机器人辅助前列腺切除术,可显著降低手术切缘阳性率(PSM),进一步优化了手术治疗效果8。
二、前列腺癌手术治疗与系统治疗联合应用探索
朱耀教授分享了,局限性及转移性前列腺癌的治疗策略近年来取得显著进展,尤其是新辅助治疗和减瘤性手术的引入,极大地改善了高危患者的生存结局。
局限性前列腺癌新辅助治疗探索之路
AUA协会提出新辅助治疗作为多模式治疗的一部分,未来可将其作为强化高危局限性前列腺癌患者管理新选择。前列腺癌的新辅助治疗探索经历了从传统内分泌治疗向新型联合策略的演进。早期研究集中于新辅助雄激素剥夺治疗(ADT)和新辅助化疗,虽在病理降期方面显示出一定效果,但未能显著改善患者的无进展生存期。随着雄激素受体通路抑制剂(ARPI)的问世,新辅助治疗格局得以重塑。目前,多项II/III期临床研究正在开展,旨在评估ARPI单药或联合方案在高危局限性前列腺癌中的疗效与安全性9。其中,达罗他胺为基础的三联疗法也在局部晚期前列腺癌(LPC)患者的新辅助治疗中进行了初步探索10。
与此同时,靶向放射配体疗法如177Lu-PSMA-617也正将其应用从晚期阶段前移至新辅助治疗场景,目前已有多项研究评估Lu-PSMA新辅助治疗局限性/局部晚期前列腺癌患者的疗效和安全性11。2023年EAU大会报道的I/II期LuTectomy研究12显示,45%的患者达到PSA50缓解率,随访12.9个月时无生化复发生存率达到80%,177Lu-PSMA-617治疗后手术安全性和总体安全性总体表现良好。
综上,前列腺癌的新辅助治疗已进入一个以ARPI为基础、不断探索联合强化治疗和精准靶向治疗的新时代。
减瘤术在转移性前列腺癌中的临床价值
鉴于转移性前列腺癌的高度异质性,减瘤术已成为其多模式治疗的重要组成部分,无论在作用机制还是临床疗效方面,均显示出显著优势。当前,ADT联合系统治疗±姑息放射治疗(pRT)已成为寡转移性(低瘤负荷)激素敏感性前列腺癌的标准治疗方法13。研究表明14,低瘤负荷mHSPC患者行放疗可显著改善总生存(OS)和无失败生存期(FFS),可见放疗减瘤治疗可为低瘤负荷mHSPC患者带来更佳的生存获益。CSCO指南已15将ADT + 放疗作为低瘤负荷mHSPC的I级推荐,ADT + 手术作为II级推荐,体现手术在多模式治疗中的地位提升。
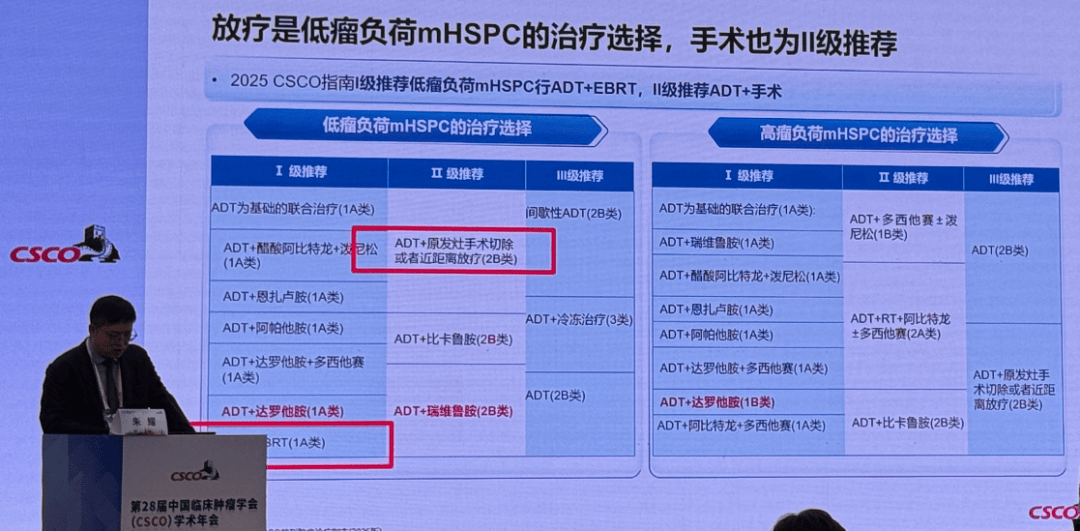
在生存结局方面,前列腺癌手术减瘤与放疗能够达到同等生存获益。一项前瞻性多中心研究16显示,对于新诊断低瘤负荷mHSPC,减瘤性前列腺切除术(cRP)与放疗(RT)在总生存率方面相当,且均显著优于非局部治疗组。
既往大型研究的亚组分析显示,ARPI能为寡转移患者带来生存获益,目前多项相关大型III期研究正在进一步探索ARPI联合ADT治疗寡转移mHSPC的疗效及安全性。已经有研究探讨了减瘤术联合系统性治疗在寡转移性/低瘤负荷激素敏感性前列腺癌中的应用,一项II期、单臂、多中心、开放标签的研究探索了达罗他胺三联治疗后进行根治性前列腺切除术在mHSPC患者中的可行性和安全性17。
达罗他胺+ADT带来mHSPC全人群获益
朱耀教授谈到,在前列腺癌的整体治疗策略中,手术治疗往往是局部干预的重要起点,而术后综合管理则对患者的长期生存至关重要。对于不适合或无需化疗的mHSPC患者,探索有效的二联治疗方案也具有重要意义。ARANOTE研究评估了达罗他胺联合ADT对比安慰剂联合ADT治疗mHSPC患者的疗效和安全性。2024 ESMO大会公布其主要终点,与安慰剂相比,达罗他胺组的影像学进展或死亡风险降低46%(HR=0.54;95% CI 0.41-0.71;P<0.0001)。在所有预先设定的亚组中都观察到一致的rPFS获益18。

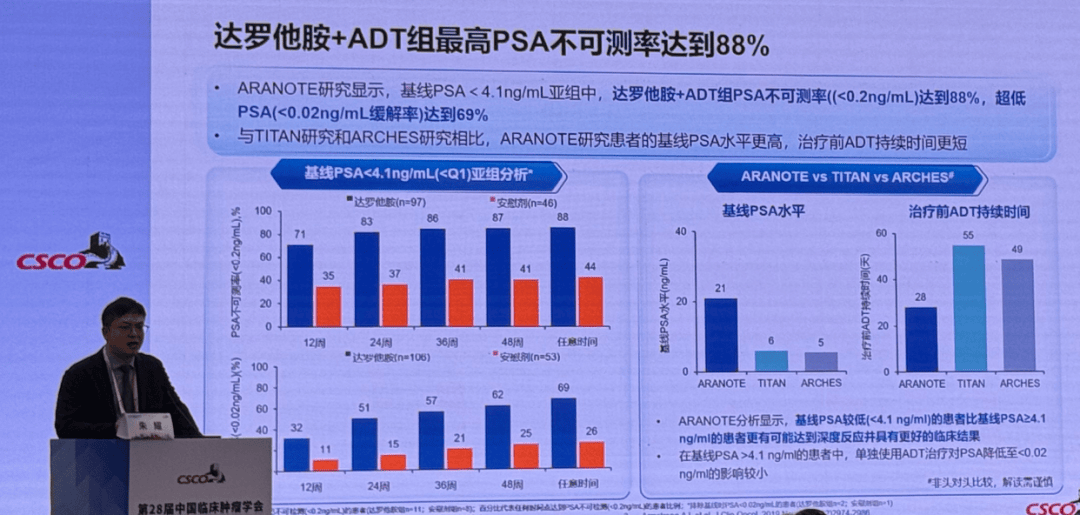
ARANOTE研究基于基线PSA水平的亚组分析显示19,达罗他胺+ADT组最高PSA不可测率达到88%,超低PSA(<0.02ng/mL)缓解率达到69%;而且与同类型临床研究相比,ARANOTE研究患者的基线PSA水平更高,治疗前ADT持续时间更短。
总结
最后,朱耀教授总结到,前列腺癌的诊疗领域正在经历一场深刻的范式转移。其核心特征是从单一治疗方式向以手术为基础、内外科紧密结合的整合模式演进。从技术手段上来看,机器人手术、影像导航、人工智能等创新技术共同推动了外科手术迈向精准化与功能保留的新高度,为治愈提供了更优的技术保障。在治疗策略方面,治疗关口前移与联合应用成为主流。无论是新辅助治疗对病理降期的显著改善,还是减瘤术在精选转移患者中带来的生存获益,都证明了局部治疗与系统治疗强强联合的巨大潜力。其中,以达罗他胺为代表的新型内分泌治疗,凭借其卓越的疗效和安全性,从mHSPC的基石治疗到围术期的探索,正扮演着越来越关键的角色。
展望未来,前列腺癌的诊疗将继续朝着精准化、个体化、全程化的方向深入发展。通过多学科团队的紧密协作,深度融合手术创新与药物研发成果,有望为不同阶段的前列腺癌患者制定出最优的治疗策略,最终实现提升生存率与生活质量的双重目标。
参考文献
1. 2024 EAU. abstract A0004.
2. 2025 EAU P495.
3. Moretti TBC, et al. Andrology. 2024;12(8):1865-1871.
4. Shen C, et al. Eur Urol Focus. 2024 Dec;10(6):1019-1026.
5. Dai ZK, et al. J Robot Surg. 2024 Dec 12;19(1):21.
6. Guo P, et al. World J Urol. 2025 Apr 2;43(1):205.
7. Chen S, et al. Eur Urol. 2025 Jun;87(6):717-727.
8. Bergero MA, et al. Sci Rep. 2025 Aug 21;15(1)30822.
9. Gómez Rivas J, et al. Cancers(Basel). 2024 Dec 31;17(1)99.
10. 裴昕奇, 等. 新辅助达罗他胺联合多西他赛在治疗局部晚期前列腺癌的效果(2025 CUA).
11. Mirzaei S, et al. Wien Klin Wochenschr. 2025 Jun;137(Suppl 4)157-166.
12. Eapen RS, et al. Eur Urol. 2023 Oct 25S0302-2838(23)03087-7.
13. Rajan, K. et al. Cancers 2025, 17, 2757.
14. Ali A, et al. JAMA Oncol. 2021 Apr 1;7(4):555-563.
15. 2025 CSCO 前列腺癌诊疗指南
16. Lumen N, et al. Eur Urol Open Sci. 2021;29:68-76.
18. Fred Saad, et al. 2024 ESMO, Abs LBA68.
责任编辑:CY
排版编辑:Crystal
版权声明
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。





