抑郁症是全球健康的一大负担,2019 年冠状病毒病大流行对精神健康造成的不利影响更是加剧了这一状况。上海交通大学医学院附属第六人民医院在《Cell Metabolism》上发表了题为“Gut bacteria-driven homovanillic acid alleviates depression by modulating synaptic integrity”的研究成果,在此研究中,通过抑郁症小鼠模型研究了这些独特的肠道微生物及其调节代谢物,并进一步探索了肠道微生物代谢物与突触功能相互作用的机制,突触功能是抑郁症情绪和认知的潜在关键调节因子。进而阐明抑郁症中肠道微生物群-脑轴的复杂相互作用和分子机制,为开发抑郁症治疗靶向疗法铺平新途径。
本研究的宏基因组和部分数据分析工作由上海派森诺生物科技股份有限公司完成。
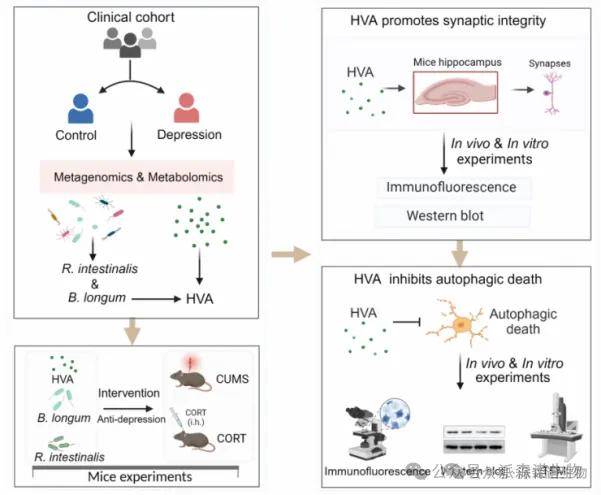 图1 技术路线图
图1 技术路线图
研究成果
1.肠道微生物代谢物HVA在抑郁症中发挥作用
通过469例参与者(包括 262 名抑郁症患者和 207 名健康对照者)组成的大队列样本采集血清和粪便,分别进行代谢组学和宏基因组学测序分析。结果表明大多数差异细菌属于四个门:厚壁菌门、变形菌门、拟杆菌门和放线菌门(图2C)。大多数神经递质在酪氨酸、色氨酸和谷氨酸代谢等代谢途径中表现出富集 。从该池中选择了三种效应量最显著的代谢物,HVA,L-色氨酸和L-酪氨酸(图2F)。
然后,对代谢物、细菌和HAMD评分之间进行 Spearman 相关性分析(图 2G)。结果显示,三种代谢物与HAMD评分负相关;代谢物HVA与细菌的相关性最强;四种肠道微生物Roseburia intestinalis、Bifidobacterium longum、Roseburia feecis 和 Eubacterium rectale,与 HVA 水平呈正相关(图 2H),在抑郁症患者中丰度较低。采用DIABLO算法评估代谢组学与宏基因组学数据之间的相关性。结果表明,这两个组学数据集之间存在显著相关性。抑郁症中血清和粪便中 HVA 的浓度降低。以上结果表明 HVA 在连接肠道微生物组和抑郁症方面的关键作用。
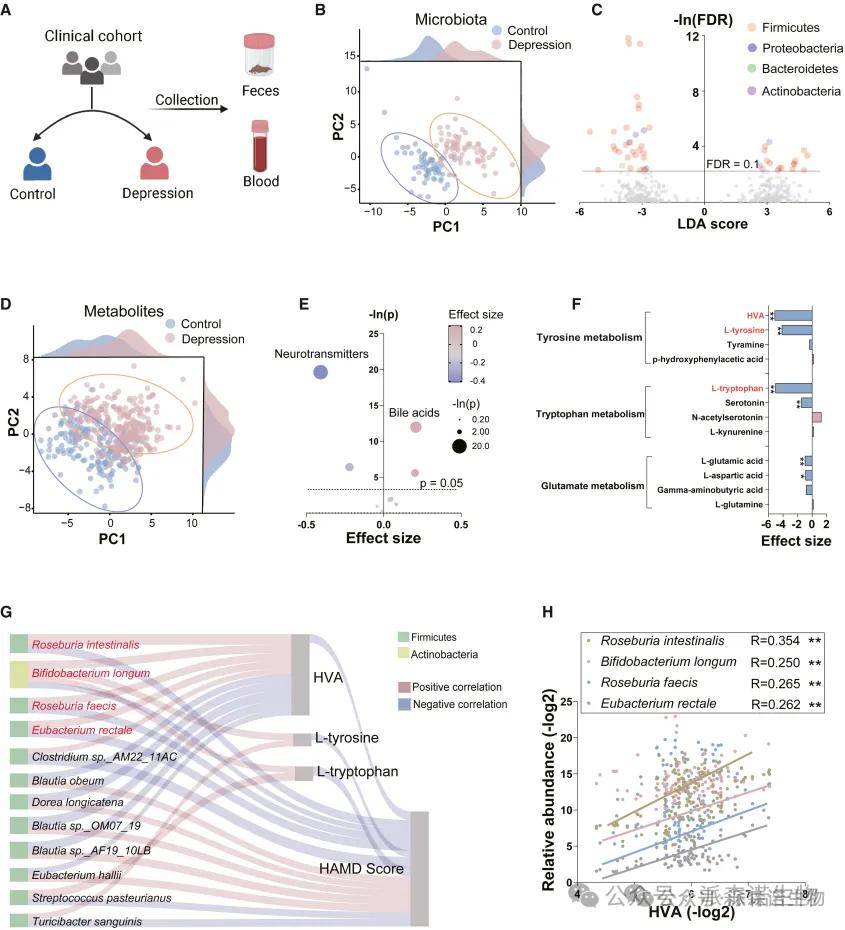 图2 (A-H) 抑郁症患者的肠道微生物组和新陈代谢发生变化
图2 (A-H) 抑郁症患者的肠道微生物组和新陈代谢发生变化
2.Intestinal B. longum在促进R. intestinalis的促进下产生 HVA
为了确定 HVA 是否是肠道微生物组衍生的代谢物,我们量化了胃肠道组织和大脑中的 HVA 水平。研究发现胃肠道HVA总量较高,与无特定病原体(SPF)小鼠相比,无菌(GF)小鼠在胃肠道组织(3B)以及大脑和血清(3C和3D)中,HVA水平显着降低。这些结果强调了肠道微生物组对 HVA 产生的重大贡献。
以小鼠饲料提取物为底物体外单独培养每种细菌。结果表明,B. longum可以产生HVA。将这三种细菌各自施用于小鼠,发现在 R. intestinalis 给药后,B. longum的相对丰度和HVA水平显著升高(图3G 和图3H),表明 R. intestinalis 可以增强B. longum的丰度,进而产生 HVA。且在体外共培养 B. longum 和 R. intestinalis时无法观察到这种促进,证实了体内肠道微生物组之间的动态和复杂的相互作用。
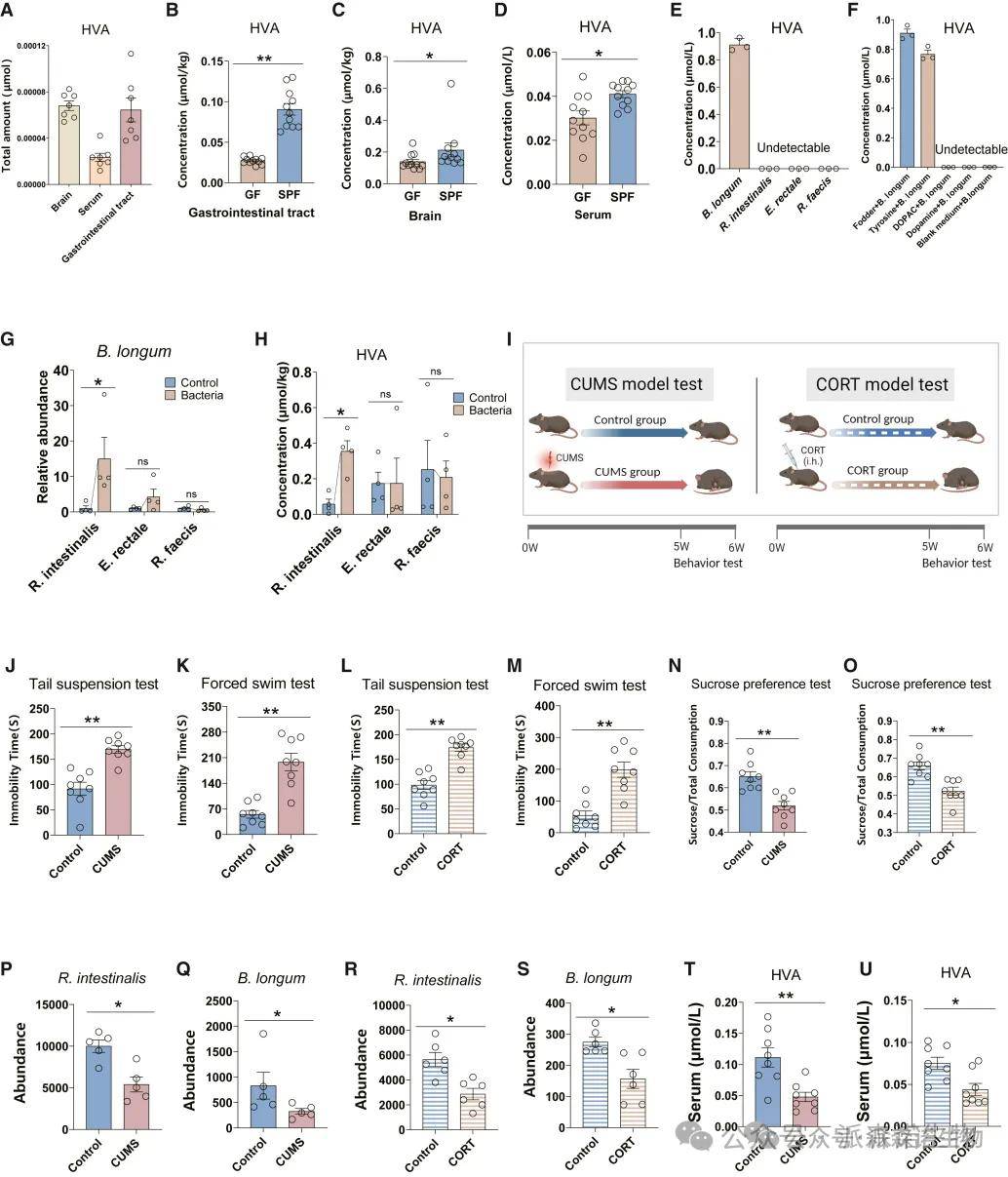 图3(A-U) 抑郁症小鼠模型中的肠道微生物群和 HVA 代谢。
图3(A-U) 抑郁症小鼠模型中的肠道微生物群和 HVA 代谢。
3.Intestinal B. longum和R. intestinalis以及HVA在具有抑郁行为的小鼠模型中耗尽
为了验证临床抑郁症患者肠道微生物组和代谢物改变,进一步研究了小鼠模型中Intestinal B. longum、R. intestinalis和 HVA 的变化。使用了两种具有抑郁行为的成熟小鼠模型,包括CUMS模型和CORT干预模型(图3I)。在两种模型中,盲肠内容物中B. longum和R. intestinalis的丰度(图3P-3S)以及HVA的血清浓度(图3T和3U)均显著降低。
4.HVA、B. longum 或 R. intestinalis 可缓解小鼠的抑郁表型
接下来进一步研究了 HVA 和肠道微生物是否具有治疗小鼠模型抑郁症的潜力。首先评估药代动力学参数以确定HVA的给药剂量,由于HVA的吸收半衰期约为6小时,每天两次用HVA治疗小鼠以保持其血清浓度。基于这些参数,在CUMS和CORT小鼠模型中以100或300mg / kg的剂量施用HVA,每天两次,持续5周。行为表型测试表明HVA对抑郁症和心率变异性(HRV)具有治疗作用,作为迷走神经活动的指标。300 mg/kg 剂量的 HVA 在改善抑郁表型方面比 100 mg/kg 更有效。
然后,用HVA,B. longum和R. intestinalis每天两次,持续5周(图4B和4C)。行为测试表明,干预后不动时间显着减少(图 4D-4G)和蔗糖偏好增加(图 4H 和 4I)。还观察到基于成熟脑源性神经营养因子(mBDNF)蛋白表达增加的神经保护作用,mBDNF蛋白是神经源性加工中的关键调节蛋白(图4J和4K)。这些结果表明 HVA、B. longum 和 R. intestinalis 在缓解小鼠抑郁表型方面的潜力。
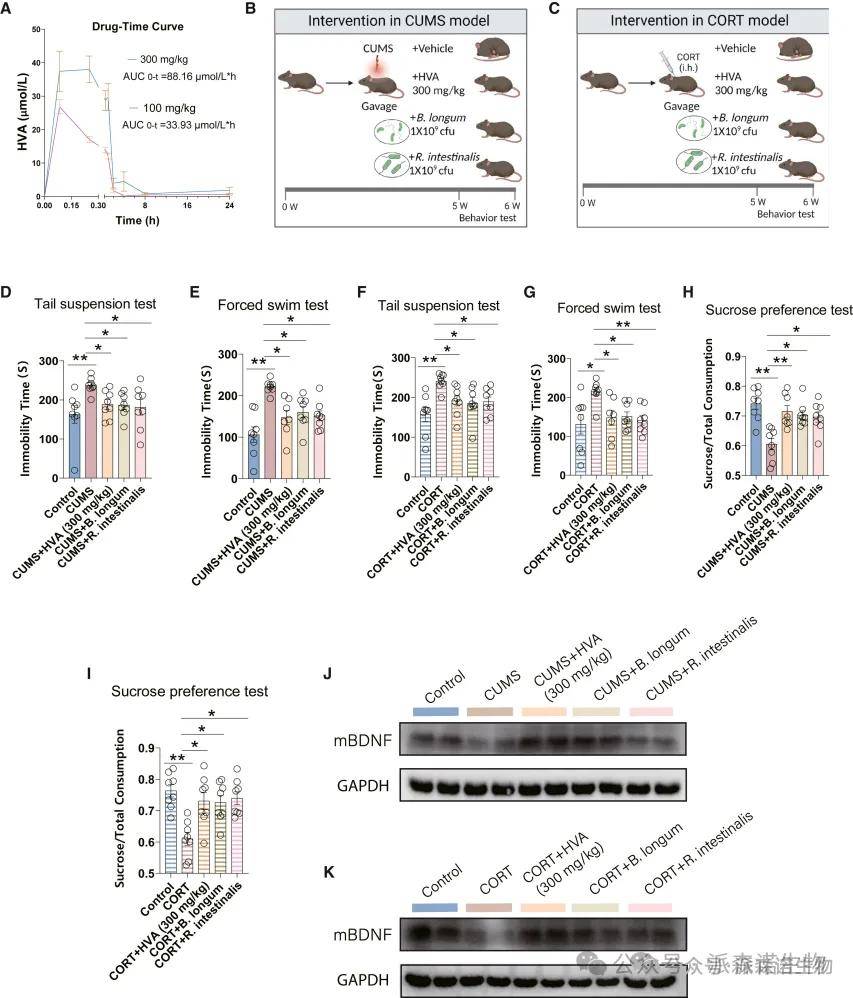 图4(A-K) HVA、B. longum 或 R. intestinalis 可缓解小鼠模型中的抑郁表型
图4(A-K) HVA、B. longum 或 R. intestinalis 可缓解小鼠模型中的抑郁表型
5.HVA 通过恢复海马突触来缓解抑郁症
由于 HVA 对抑郁症具有治疗作用,增加海马体中 mBDNF 的表达,假设肠道来源的 HVA 可以穿过血脑屏障 (BBB) 并直接在大脑内发挥抗抑郁作用。因此,将同位素标记的HVA-d3施用于小鼠,可以在血清和三个大脑区域(延髓、海马体和前额叶皮层)(图5A)中检测到,表明HVA可以穿透BBB。我们还发现,接受HVA和B. longum干预的小鼠大脑中的HVA浓度显著增加(图5B和5C)。与SPF小鼠相比,GF小鼠的HVA水平降低(图5B-5D)证实了大脑中的HVA受肠道微生物组的调节。
因为海马体的突触损伤被认为是抑郁症的主要病理基础,进一步探索了接受HVA,B. longum或 R. intestinalis治疗的CUMS和CORT小鼠模型中的突触可塑性 。免疫荧光分析(图5D和5E)和蛋白质印迹分析(图5F和5G)显示,海马体中的突触前膜蛋白突触蛋白-1(SYN1)在治疗下显著上调。结果表明,HVA保护了海马神经元的突触前膜,并减轻了与抑郁症相关的突触功能障碍。
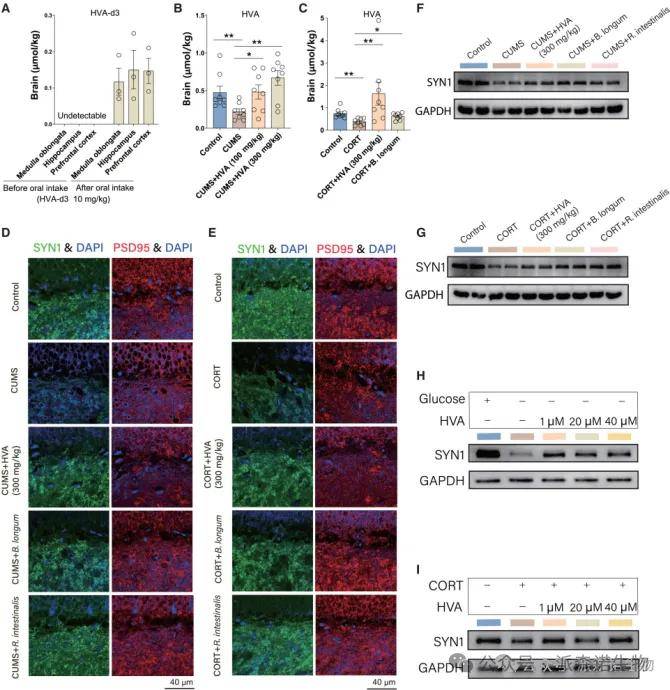 图5(A-I)HVA 减轻海马体突触丧失
图5(A-I)HVA 减轻海马体突触丧失
6.HVA 通过抑制自噬死亡来促进突触可塑性
作者进一步探讨了HVA在自噬中的作用,以阐明突触可塑性改善的机制。自噬的发生涉及一个非常复杂的机制,我们检查了微管相关蛋白1轻链3(LC3)和SQSTM1/p62的表达,其是在海马体的齿状回 (DG)区域的自噬生化标志物(图6A)。与对照组相比,在抑郁小鼠模型中观察到过度自噬,LC3 和 SQSTM1/p62 蛋白表达降低。HVA 干预后,这些蛋白的表达正常化,类似于在正常小鼠中观察到的水平。当用 B. longum 或 R. intestinalis 处理时,也观察到HVA的这种影响(图6B-C)。
然后在HT22小鼠海马神经元细胞系中进行了体外实验,其中自噬是通过葡萄糖剥夺或 CORT 诱导的。随后,用HVA和自噬抑制剂氯喹处理细胞。葡萄糖剥夺后,HT22细胞经历了细胞密度降低、广泛的细胞死亡和明显的过度自噬,其特征是 LC3 和 SQSTM1/p62 蛋白的耗竭以及自噬体内容物的降解。接受HVA和氯喹处理的细胞减轻了自噬体内容物的过度降解(图6D-E)。在暴露于CORT的细胞中,我们还发现HVA抑制LC3蛋白的转化,抑制自噬体的形成(图6F-G)。综上所述,HVA通过调节蛋白质水平和自噬体数量,对过度自噬发挥抑制作用。
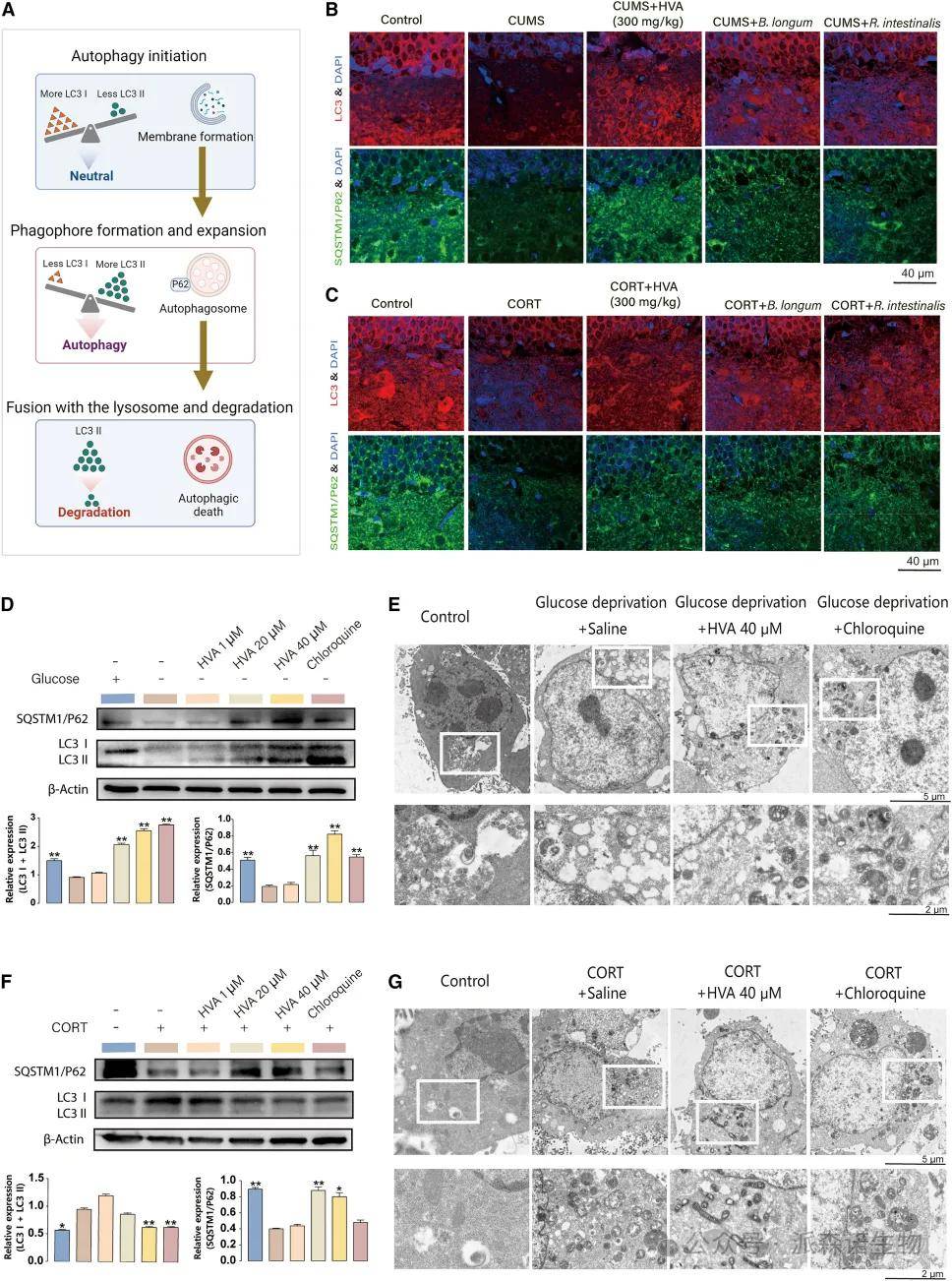 图6(A-G)HVA 通过抑制自噬死亡来增加海马突触可塑性
图6(A-G)HVA 通过抑制自噬死亡来增加海马突触可塑性
研究结论
研究表明,HVA由B. longum产生,由含有R. intestinalis的混合菌增强,可有效减轻抑郁并调节突触完整性。该发现强调了肠道微生物群在调节突触完整性方面的作用,并为抑郁症的新治疗策略提供了见解。
原文链接:https://doi.org/10.1016/j.jhazmat.2024.136827