【导读】与 MSI-H 型胃癌不同,GS 和 CIN 型表现出免疫惰性微环境,对免疫检查点阻断(ICB)疗法反应极小,因此需要新的策略来克服免疫治疗耐药性。
8月15日,上海交通大学研究团队在期刊《Journal of Experimental & Clinical Cancer Research》上发表了研究论文,题为“TRIM6 ablation reverses ICB resistance in MSS gastric cancer by unleashing cGAS-STING-dependent antitumor immunity”,本研究结果阐明了 TRIM6 介导的抗肿瘤免疫抑制是 MSS 型胃癌对免疫检查点阻断疗法产生耐药性的新机制,这表明 TRIM6 既是免疫冷亚型的预测性生物标志物,也是治疗靶点。

背景知识
01
胃癌(GC)是全球第五大常见恶性肿瘤,也是癌症相关死亡的第四大原因。癌症基因组图谱(TCGA)分类系统将胃腺癌分为四种分子亚型:EB 病毒阳性(EBV 阳性,9%)、微卫星不稳定性高(MSI-H,22%)、染色体不稳定(CIN,20%)和基因组稳定(GS,50%)。亚洲癌症研究组(ACRG)分类系统将胃癌分为四种分子亚型:微卫星不稳定性(MSI,23%)、微卫星稳定伴上皮间质转化(MSS/EMT,15%)、MSS/TP53+(26%)和 MSS/TP53−(36%)。在这些亚型中,EBV 阳性和 MSI-H 胃癌对免疫治疗表现出显著的敏感性,而 GS 和 CIN 类型对免疫检查点阻断(ICB)的反应极小。临床试验一直表明,帕博利珠单抗在这些免疫原性亚型中具有很高的疗效,EBV 阳性 GC 患者的总体缓解率(ORR)为 100%,MSI-H GC 的 ORR 为 85.7%。相比之下,GS 和 CIN 亚型对 PD-1/PD-L1 抑制剂治疗反应有限或无反应,这反映了它们免疫学上“冷”的肿瘤微环境。
TRIM6 的耗竭通过激活胃癌中的先天免疫反应增加 CD8+ T 淋巴细胞的浸润
02
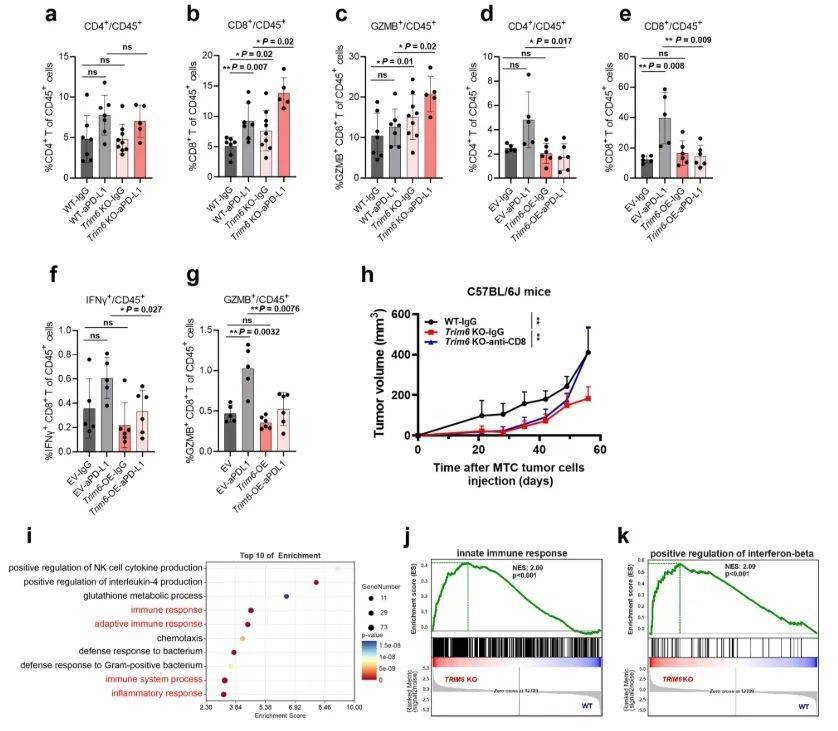
为了探究 TRIM6 调节胃癌对免疫检查点阻断(ICB)疗法敏感性的机制,研究人员通过流式细胞术分析了两种小鼠肿瘤模型(Trim6 基因缺失的 MTC 模型和 Trim6 基因过表达的 MFC 模型)在抗 PD-L1 治疗下的肿瘤浸润淋巴细胞。研究显示,在抗 PD-L1 治疗下,Trim6 基因缺失使 MTC 肿瘤中 CD8+ 和 CD8+ GZMB+ T 细胞的比例增加,但 CD4+ T 细胞的比例未变。相反,在抗 PD-L1 治疗下,Trim6 基因过表达使 MFC 肿瘤中有效 CD8+ T 细胞浸润减少。这些结果表明,TRIM6 对胃癌肿瘤免疫的调节可能通过 CD8+ T 细胞介导。与这一推测一致的是,用抗 CD8 抗体阻断 CD8+ T 细胞显著逆转了 Trim6 基因缺失的 MTC 模型中肿瘤生长的抑制。
TRIM6 的缺失激活了先天免疫信号传导并增加了 CD8+ T 细胞的浸润
接下来,研究人员使用 RNA 测序对野生型(WT)和 Trim6 基因敲除(KO)的甲状腺髓样癌(MTC)肿瘤进行了转录组学分析。基因本体论(GO)富集分析显示,当 Trim6 缺失时,与免疫反应和炎症反应相关的多个通路富集。基因集富集分析(GSEA)表明,先天免疫反应和干扰素β产生的正向调节通路在 Trim6 基因敲除的 MTC 肿瘤中富集。这些数据表明,TRIM6 可能通过影响先天免疫反应来调节抗肿瘤免疫和免疫治疗敏感性。
结论
03
总之,本研究证明,TRIM6 水平升高是微卫星稳定型胃癌的特征,并且与微卫星不稳定性状态呈负相关。从临床角度来看,TRIM6 水平高与细胞毒性 T 淋巴细胞浸润减少以及对帕博利珠单抗治疗反应较差有关。通过在微卫星稳定/微卫星不稳定性低的胃癌细胞系和小鼠微卫星稳定模型中的基因敲除研究,研究人员发现TRIM6 缺失可恢复 cGAS 蛋白的稳定性,重新激活 cGAS-STING-IFNβ 信号轴,并增强抗肿瘤免疫。这些发现表明,靶向 TRIM6 有可能将免疫冷胃肿瘤转化为对免疫治疗有反应的免疫热表型。
参考资料:
【关于投稿】