【导读】骨转移(BM)是前列腺癌(PCa)预后不良的主要因素;然而,前列腺癌骨转移的潜在机制仍不清楚。
近日,中国科学技术大学/中山大学/中南大学湘雅二医院研究团队合作在期刊《Advanced Science》上发表了研究论文,题为“Epigenetic Activation of CCDC183-AS1 Promotes Osteoclastogenesis and Prostate Cancer Bone Metastasis Through the FUBP1/LIGHT Axis”,在这项研究中,研究人员发现前列腺癌骨转移(PCa BM)中 CCDC183-AS1 显著上调,且与疾病进展相关。CCDC183-AS1 过表达通过诱导破骨细胞生成和协助骨髓微环境的形成,增强了前列腺癌细胞向骨转移的能力。从机制上讲,CCDC183-AS1 与 FUBP1 相互作用,通过抑制 JTV-1 介导的 FUBP1 泛素化和降解来增强其稳定性,从而促进 TNFSF14(LIGHT)的转录。尤其是,选择性 FUBP1 抑制剂 FUBP1-IN-1 的给药被证明能有效抑制 CCDC183-AS1 诱导的前列腺癌骨转移。这些结果揭示了 CCDC183-AS1 在促进破骨细胞生成以及促进前列腺癌骨转移的潜在机制中的作用,为治疗干预提供了可能的途径。

研究背景
01
在全球范围内,前列腺癌(PCa)是男性中第二常见的恶性肿瘤。虽然局限性前列腺癌的 5 年生存率高达 100%,但近 90% 的晚期前列腺癌患者会发生骨转移(BM),导致 5 年生存率大幅降低至不足 30%。癌细胞常常转移到特定器官,而前列腺癌的主要转移部位是骨骼。骨转移会导致骨相关并发症,从而降低患者的生活质量并预后不良。遗憾的是,针对前列腺癌骨转移的治疗手段有限。尽管早期研究已强调蛋白质和非编码 RNA 在前列腺癌骨转移中的重要作用,但其确切的分子机制和临床应用尚未完全明了。因此,迫切需要进一步了解前列腺癌骨转移的特定分子机制,并开发创新的治疗策略。
FUBP1-IN-1 抑制 CCDC183-AS1 诱导的体外破骨细胞生成及体内前列腺癌骨转移
02
上述结果强调了 KDM5C/CCDC183-AS1/FUBP1/LIGHT 轴在前列腺癌骨转移(PCa BM)中的重要性,并表明有必要进一步研究这些成分作为治疗前列腺癌骨转移的潜在靶点。值得注意的是,新出现的研究表明 FUBP1 可能具有癌基因的功能,这一点从其在多种肿瘤类型中的上调间接得到证实。FUBP1-IN-1 是一种新型的小分子抑制剂,其作用机制是通过破坏 FUBP1 与 FUSE 样 DNA 序列之间的相互作用来实现的。因此,研究人员研究了 FUBP1-IN-1 在治疗骨转移中的潜力。研究结果表明,FUBP1-IN-1 显著抑制了 LIGHT 的表达,并逆转了 CCDC183-AS1 对 LIGHT 在 mRNA 和蛋白质水平上的促进作用。此外,荧光素酶报告基因实验表明,FUBP1-IN-1 抑制了野生型 F4 报告基因的活性,而突变型 F4 报告基因则未受影响。染色质免疫沉淀实验进一步证实了 FUBP1-IN-1 在阻碍 FUBP1 与 P1 位点结合方面的抑制能力,表明 FUBP1-IN-1 通过阻断 FUBP1 与 FUSE 样序列的相互作用来破坏 FUBP1 的转录调节活性。从功能上看,FUBP1-IN-1 显著减少了前列腺癌细胞诱导的破骨细胞生成,降低了 TRAP+ 破骨细胞的数量和骨吸收坑的面积,并抑制了足突的形成。接下来,研究人员使用体内模型评估了 FUBP1-IN-1 对前列腺癌骨转移的潜在治疗效果。与载体治疗相比,FUBP1-IN-1 治疗显著延缓了骨转移的发生,降低了骨转移负荷、骨溶解面积和 TRAP+ 破骨细胞的数量。研究结果表明,FUBP1-IN-1 在抑制骨髓瘤方面显示出潜力,并可能为治疗这种疾病提供新的策略。
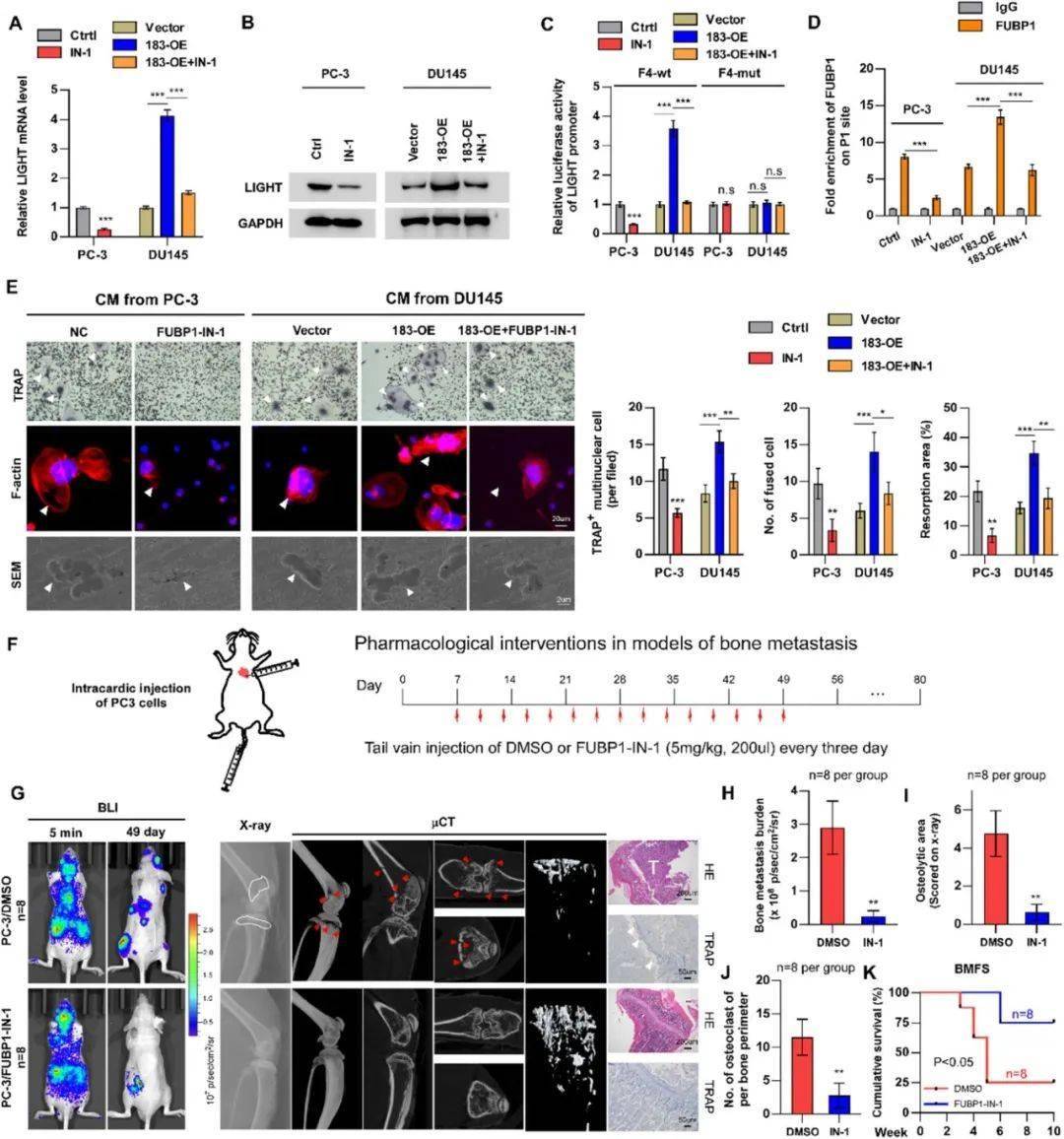
FUBP1-IN-1 在体外抑制 CCDC183-AS1 诱导的破骨细胞生成,在体内抑制前列腺癌骨转移中的破骨细胞生成
参考资料:
【关于投稿】





