肺是人体最重要的器官之一,大多数人都认为心脏最重要,其实没有了空气交换之后,一切都会停止。心跳停止的时候可能没有过多的痛苦,但是呼吸不能自主的时候肯定那种痛苦可想而知。
然而健康时我们很少关注肺的作用,但一旦肺的功能出了问题,人们就再也难以轻松快乐生活,尤其是慢性肺病。
慢性肺病不仅影响损害会身心健康,降低生活质量,

也会给家庭带来巨大经济负担,对整个社会的医疗系统和经济造成重大压力。


由于进展缓慢、症状初期不明显,慢性肺病很容易被忽视。一旦病情加重,不仅治疗成本大,还严重削弱生活质量。这是一类目前公认的全球重要的、可预防但负担极重的慢性病之一。
到医院看肺病的时候可能医生会告诉你治疗肺,但是大量研究发现,虽然肺病的核心病理部位在肺,但诱发问题的根源可能出在口腔和鼻腔。所以治疗起来把握源头,断绝源头输送可能同样重要。

在本期和随后的文章中,食与心将结合最新研究,介绍口腔健康与各种肺部疾病之间的关联,以及针对这种关联怎样提升肺部健康。首先让我们关注带来最大疾病负担的慢阻肺。
——慢阻肺与肺气肿
慢阻肺,全称是慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease, COPD),是一种慢性进行性的肺部疾病,主要表现为气流受限不可逆,呼吸困难加重,常伴有咳嗽、咳痰、喘息等症状。它是全球第三大致死原因,对健康和生活质量造成重大影响。
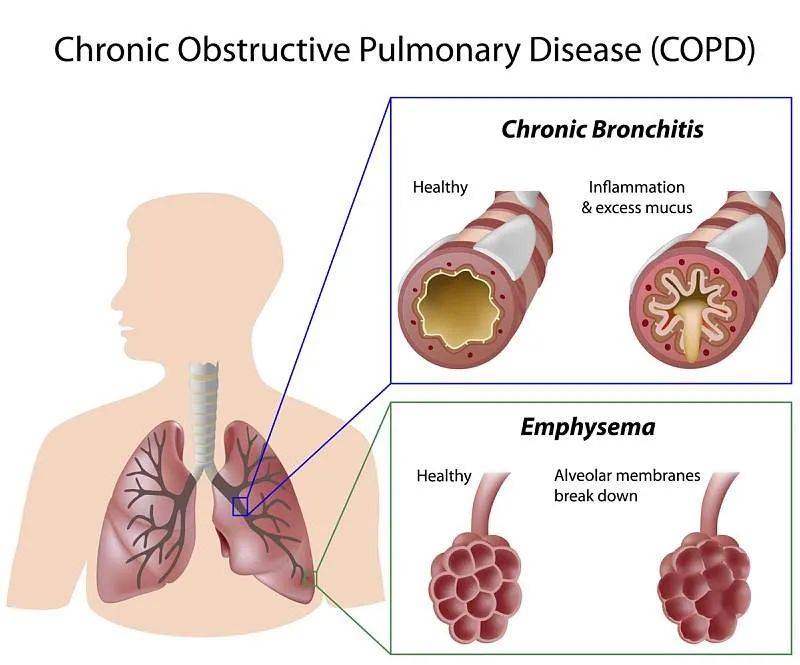
慢阻肺包括两种主要病理类型:慢性支气管炎和肺气肿,两种病状常常共有,并共同导致慢阻肺的临床表现和肺功能下降。
下面是这两者的区别与联系:


在实际临床中,大多数慢阻肺患者同时存在这两种病变,只是比例和表现不同。
- 以咳嗽、咳痰为主的患者多偏向慢性支气管炎型;
- 以呼吸困难为主的患者多偏向肺气肿型。

也就是说,慢阻肺 ≠ 单一疾病,而是以慢性支气管炎 + 肺气肿为基础,导致持续性气流受限的一组综合征。

目前临床治疗上治疗上已不再强调“是哪种型”,而是依据症状严重程度、肺功能和加重风险等综合评估来个体化治疗。
——慢阻肺与口腔问题
下图列出了目前公认的慢阻肺风险因素

直到口腔微生物研究披露这种关系为止,医学中未曾将口腔问题纳入慢阻肺的风险因素中。事实上,越来越多的人体共生微生物研究和大数据表明,口腔疾病不仅是慢阻肺的伴随问题,甚至可能是其发病和加重的潜在影响因素之一。
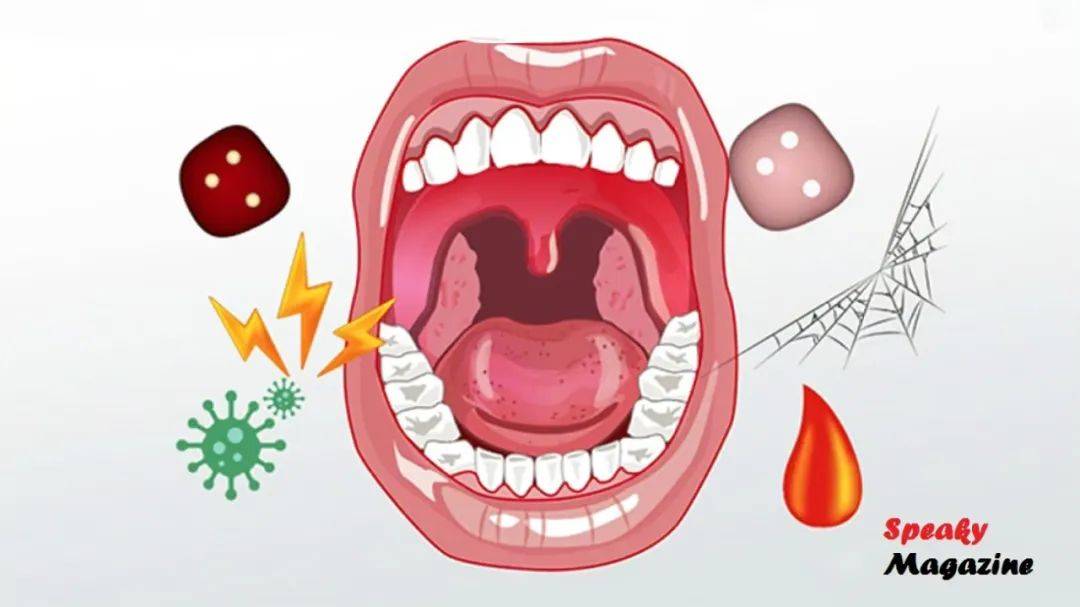
慢阻肺患者往往有口腔问题,比如牙周病、口干、龋齿、口腔真菌感染等。

流行病学研究发现:
- COPD患者牙周健康状况明显差于普通人群。
- 牙周治疗可降低COPD急性加重的频率。
- 口腔细菌如梭杆菌、普雷沃氏菌、Porphyromonas(卟啉单胞菌)在慢阻肺患者肺部也可检测到,提示“口-肺轴”这种连贯的关系存在,同时提示了慢阻肺中,口腔微生物可能是帮凶。
慢阻肺与口腔健康之间存在双向关联。


口腔问题会加速慢阻肺发展,而良好的口腔卫生不仅有助于预防感染、减少COPD加重,还可提升生活质量。


——慢阻肺与共生微生物失衡
慢阻肺不仅是一种呼吸系统疾病,也与全身微生态失衡密切相关。不断有新的研究发现,口腔菌群、气道菌群和肠道菌群等共生微生物群在慢阻肺的发生、发展和急性加重中都起着重要作用。


口腔是人体呼吸道(气道)和消化道(肠道)的共同入口,是人体第二大菌群聚集地(仅次于肠道),拥有超过 700种微生物。多年前哈佛医学院和乔斯林医学院合作研究揭示了一个惊人的信息,口腔中微生物编码的基因甚至多于肠道中的微生物编码基因!从这个研究可以想象,所有吃进去和呼吸进去的微生物第一关就是要通过口鼻的处理,口腔中食物残渣的营养远远高于消化道的水平,可以滋生意想不到的、形形色色的微生物。

口腔不仅包含有益微生物(如链球菌和唾液乳杆菌)和中性微生物,还包含多种致病微生物(如牙龈卟啉单胞菌),肺部的致病菌有相当部分来自口腔。

气道菌群是指分布在鼻腔、咽喉、气管、支气管和肺泡等部位的微生物群落,主要包括:
- 正常菌群(如:链球菌、奈瑟菌等);
- 条件致病菌(如:流感嗜血杆菌、肺炎链球菌);
- 潜在的有害菌(如铜绿假单胞菌、鲍曼不动杆菌等)。
对于慢阻肺这种肺部疾病,气道菌群无疑处于核心战场,参与健康和疾病之间的争斗。
健康人的气道菌多样性较高,优势菌包括链球菌属(Streptococcus)、奈瑟菌属(Neisseria)等。而慢阻肺患者气道菌群多样性下降,致病菌如嗜氧革兰阴性菌铜绿假单胞菌、嗜肺军团菌、肺炎克雷伯菌增加。

肠道是人体最大的免疫器官,肠道菌群是人体最大最复杂的微生态系统,拥有的微生物数量是人体细胞总量的10倍以上。虽然肠道与肺并不直接相通,这里依然是疾病发生时的副战场,慢阻肺患者的肠道菌群也发生了改变。

那么,调整口腔、肠道和气道的菌群失衡,能改善慢阻肺吗?
——益生菌能改善慢阻肺吗
越来越多的动物实验证据显示,益生菌可能通过以下途径提升肺部功能,改善慢阻肺:


2024年的一篇报告对以往益生菌干预慢阻肺的随机对照研究进行了荟萃分析,最终纳入了3项随机、对照、双盲临床试验和 5 项随机对照动物研究。【1】
分析发现:
- 对于肺功能,益生菌干预显著改善了稳定器慢阻肺患者的 %FEV1 。(FEV1是最大深吸气后做最大呼气,最大呼气第一秒呼出的气量的容积,FEV1%测定是判定哮喘和COPD的一个常用指标。正常值为83%,值越低表示呼吸能力受损越严重)
- 对于炎症,益生菌增加了慢阻肺动物肺部的IL-10 (主要抗炎因子)并降低了炎症标志物(如 TNF-α、IL-1β 和 IL-6)含量 。
- 对于肺结构,益生菌显著降低了慢阻肺动物肺胶原纤维沉积的程度。(肺部胶原纤维沉积是慢阻肺的重要病理特征之一,特别在小气道壁和支气管周围,反映了慢性炎症所致的组织重构。这一变化对慢阻肺的不可逆性、治疗难度和病情进展都有重要影响。)
2024年7月,美国的一项流行病学调查(7486名参与者 )对2007-2012 年期间连续三个 NHANES 周期的数据进行了分析,最终纳入7486名符合标准的参与者 ,年龄在20岁以上,初始无慢阻肺,非孕妇,有益生菌、益生元和酸奶摄入量信息。【2】
结果显示,与不食用益生菌、益生元或酸奶的参与者相比,食用益生菌、益生元或酸奶的参与者患慢阻肺的几率降低了 25%。益生菌、益生元或酸奶的消费与慢阻肺患病率降低相关,即使在调整了性别、教育、年龄、种族、婚姻状况、BMI、饮酒、吸烟、中等强度活动、剧烈活动、高血压、哮喘和糖尿病等因素后也是如此。

这项研究与食与心在喝酸奶改善牙周病,抑制口腔致病菌介绍的研究相互印证,饮用活性发酵酸奶可能通过调节口腔菌群、抑制口腔致病菌、降低口腔炎症来提升肺部健康。
食与心所在实验室开发的NS8酸奶,几位慢阻肺患者经过多年饮用,大大改变了慢阻肺状况,患者也常常与实验室互动并提供改善信息。
2025年中国的一项随机双盲安慰剂对照组研究(120名长期暴露于PM2.5中的参与者)发现,与安慰剂组相比,4周益生菌干预不仅调整了肠道菌群,还提升了参与者的生活质量,改善了多项肺功能指标(包括FEV1、FEF50%和FEF75%等)。【3】
(肺功能气道功能评价的相关参数包含:第1秒用力呼气容积(FEV1),最大呼气中期流量(FEF25%~75%),第一秒用力呼气容积占用力肺活量百分比(FEV1/FVC),第3秒用力呼气容积/用力肺活量(FEV3/FVC),用力呼气容积/慢肺活量 (FEV/SVC)。FEV1很大程度上反映大气道阻塞,小气道病变累积到一定程度FEV1才会出现异常。FEF25%~75%是小气道病变中最常用的指标,其取决于FVC,因此FVC会影响其准确度。)
食与心温馨总结:肺的问题去治理口腔,过去来说可能被认为是风马牛不相及,今天大家都认识到实际上的密切关联,口腔健康对于肺部功能状态的影响确实出乎很多人意料。特别是对于里面慢性阻塞性肺病(包括人们从前所说的慢性支气管炎和肺气肿)患者,口腔健康状态可能是疾病起始的源头,至少是疾病恶化的推手。希波克拉底说过,万病始于肠道。其实所说的肠道(gut)始于口腔鼻腔。
研究发现在慢阻肺的发生和发展过程中,气道、口腔和肠道(广义的肠道包括口腔/起始于口腔)菌群失衡发挥着关键作用。气道菌群的状态与肺部功能息息相关,而肺部的致病菌相当部分来自口腔(其他来自鼻腔),口腔和肠道的免疫状态也会持续影响肺部炎症情况。健康的口腔和肠道菌群有助于提升气道和肺部健康,而不良口腔和肠道状况则会恶化肺部状态。
除了针对肺部的直接治疗,通过益生菌、活性酸奶和益生元等方式调节口腔和肠道菌群都有助于改善肺部免疫和功能状态,从而减轻慢阻肺症状,延缓疾病进展。相对于一般益生菌产品,乳酸菌发酵食物(如活性酸奶、活性酸豆浆)和活性有益菌含片等能在口腔长时间停留的食物更有助于改善口腔菌群,提升口腔健康。
要想拥有一个健康的肺,有益菌和友好型的饮食必不可少。除了多吃活性发酵食物、富含益生元和膳食纤维的食物、抗炎食物(颜色鲜艳或气味独特的低加工食物)食物,少吃加工食品/高温烹饪食品/酒等破坏菌群的食物同样重要,同时正确的刷牙方式和时间,冲洗牙齿的做法也一定会有帮助。
总而言之,要想管理好肺部,别忽略管理好口腔。
参考材料
1. https://www.frontiersin.org/journals/cellular-and-infection-microbiology/articles/10.3389/fcimb.2024.1411222/full
2. https://onlinelibrary.wiley.com/doi/full/10.1002/fsn3.4332
3. https://pubs.rsc.org/en/content/articlelanding/2025/fo/d4fo05254d/unauth