部分慢性乙型肝炎(CHB)患者在靶向病毒RNA的反义寡核苷酸(ASO)单药治疗后可以实现功能性治愈,例如,bepirovirsen(GSK-836)和 AHB-137。相较于那些未能展现出降低或使HBV表面抗原(HBsAg)阴转的药物而言,这些药物已优于许多其他新型抗HBV药物。然而,在反义寡核苷酸(ASO)治疗结束时报告的HBsAg阴转率仅为中等程度,而治疗后随访期间的复发率较高。
为开发一款同类最佳HBV ASO,以提高功能性治愈率和/或安全性,来自 Aligos Therapeutics(ALGS) 和特宝生物的研究人员进行了相关研究并在荷兰阿姆斯特丹举办的2025年欧洲肝病年会(EASL2025)上发表了一份相关研究报告。
相比当前临床候选药物,研究人员认为将尽可能针四个方面进行改进:1)显著提高RNase H介导的活性;2)适度提高人TLR8(hTLR8)激动剂活性;3)更少的靶外效应;4)改善的ASO肝脏与肾脏浓度比。
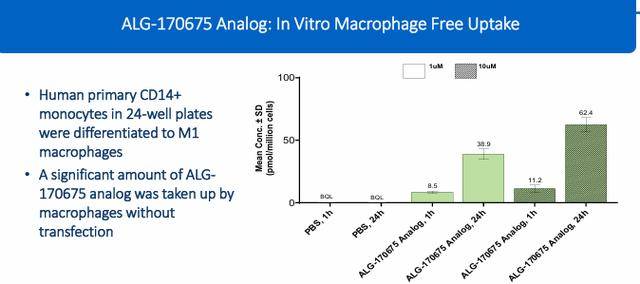
Aligos Therapeutics 开发了一种使用新型单体的ASO平台,可能减少ASO毒性并改善ASO在肝脏与肾脏之间的比例。经过严格筛选,10种HBV ASO脱颖而出,成为领先候选药物。ALG-170675是领先候选中表现最好的药物之一,与GSK-836相比,展现了良好的体外和体内特征。
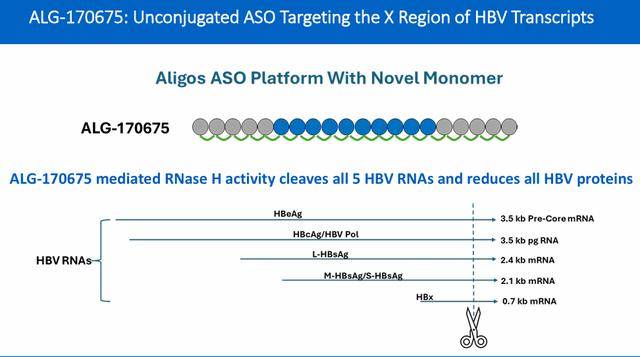
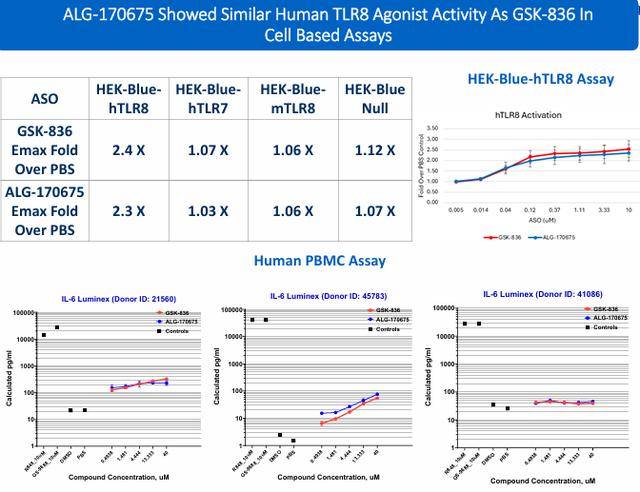
研究人员使用 HBsAg ELISA检测在 HepG2.2.15细胞系的上清液或AAV-HBV小鼠的血浆中分析体外和体内 RNase H介导活性。使用HEK-Blue hTLR8和人外周血单核细胞(PBMC)检测监测TLR8活性。为了验证体内ASO hTLR8活性,使用hTLR8敲入(KI)小鼠作为野生型小鼠缺乏功能性TLR8蛋白。通过HepG2 Caspase 3/7检测和InSphero 3-D肝细胞球体检测来测量ASO脱靶效应引起的毒性。在小鼠和猴子中监测肝脏和肾脏的ASO浓度。
截至目前,设计、合成和测试了超过1150种包含新型化学结构的HBV ASO序列。与具有标准化学结构的母体序列相比,研究人员发现利用稳定化化学结构修饰的化合物体外RNase H介导的活性在HepG2.2.15检测中可以提高约10倍(1 nM EC50)。人TLR8活性相较于在临床试验阶段的化合物基础上提高10-100%。体外Caspase 3/7活性可以降低10-100%,低于临床试验阶段化合物。
对于单个反义寡核苷酸(ASO),研究人员评估了所有三个方面的整体改善并进行了排名,以选择化合物进行体内AAV-HBV小鼠和hTLR8 KI小鼠模型研究。最终研究人员发现一种领先化合物ALG-170961具有比临床试验阶段ASO具有更好的安全性和改善的hTLR8活性。
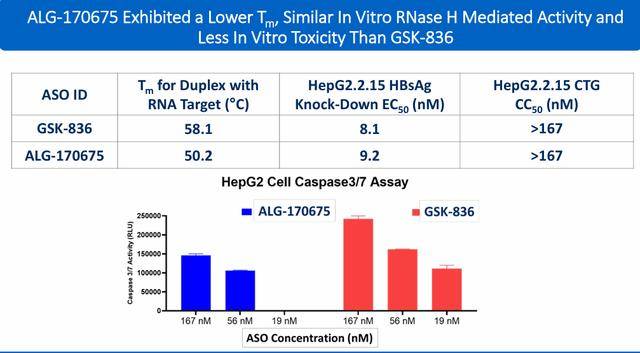

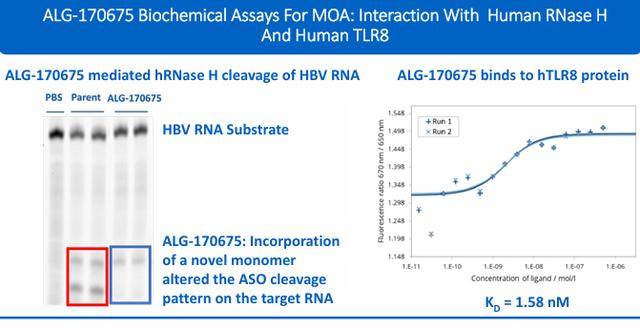
在AAV-HBV小鼠中,经过5剂ALG-170961(25 mg/kg)给药,小鼠血浆中测量的 HBsAg 从基线下降2.89 log10 IU/mL,接近定量下限(LLOQ)。与第7天相同剂量水平的临床试验阶段ASO相比,ALG-170961显示的 HBsAg 降低分别比临床试验阶段化合物#1和#2 深 61%和27%。
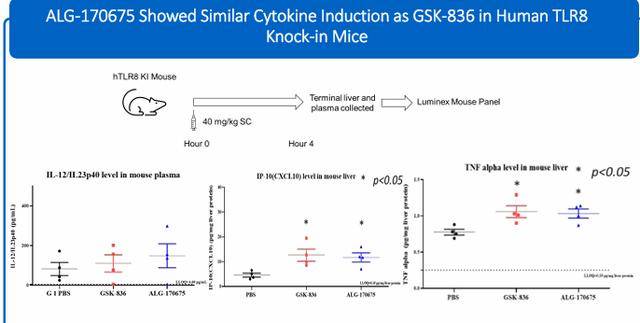
应用新型化学方法可以改善HBV反义寡核苷酸的RNase H介导,hTLR8和Caspase3/7特征。在几种领先的反义寡核苷酸中,与当前临床试验阶段的化合物相比,ALG-170961具有更好的体外安全性、增强的肝脏暴露和肝脏与肾脏的比率以及改进的体内疗效。在体外和体内观察到与GSK-836相似的hTLR8激动剂活性。ALG-170675展示了成为同类最佳级别HBV ASO的潜力。
这是时隔3年后再次看到 Aligos Therapeutics 公布针对HBV 反义寡核苷酸(ASO)的研究,在此之前, Aligos 曾有过一款已经进入人体临床试验的针对HBV的反义寡核苷酸(ASO)ALG-020572,不过由于出现严重不良事件被迫终止研究(查看详细内容:很遗憾!因严重不良事件 Aligos Thera 决定终止在研乙肝新药 ALG-020572 开发),所以, Aligos Therapeutics 这是要重新再搞针对HBV 的反义寡核苷酸(ASO)研究还是说跟特宝生物一起搞?
来源:肝脏时间





