琥珀酸脱氢酶B亚基(SDHB)突变型副神经节瘤(PGLs)是一种罕见的神经内分泌肿瘤,其特征为恶性程度高、易转移且预后较差。本文报告 1 例SDHB突变型转移性副神经节瘤病例,患者经化疗后肿瘤显著缩小且症状完全缓解。我们旨在为SDHB突变型副神经节瘤的现有认知提供更多证据。1 例 40 岁男性患者因反复低血糖及高血压危象就诊。影像学检查显示左侧腹膜后巨大肿瘤及肺部多发弥漫性转移灶。患者儿茶酚胺水平升高,符合转移性副神经节瘤诊断,病理学检查亦确认该诊断。此外,免疫组化提示SDHB表达阴性,基因检测显示SDHB体细胞突变。鉴于SDHB突变,患者在危急状态下启动环磷酰胺-长春新碱-达卡巴嗪(CVD)方案化疗。两个治疗周期后,观察到肿瘤显著缩小及生化完全缓解。2024 年 9 月CT扫描显示新发肺部病灶,CVD化疗的无进展生存期(PFS)为 24 个月。本报告总结了SDHB突变型副神经节瘤独特的临床及生化特征与治疗策略,强调在临床实践中结合基因检测与免疫组化分析的重要性。
背 景
副神经节瘤(PGLs)是一种具有高遗传率的罕见神经内分泌肿瘤。约半数副神经节瘤与琥珀酸脱氢酶x亚基(SDHx)基因突变相关。其中,SDHB突变最为常见。SDHB突变型副神经节瘤表现出独特的临床及生化特征,可能为个体化治疗提供指导。本文报告 1 例SDHB突变型转移性副神经节瘤病例,经环磷酰胺-长春新碱-达卡巴嗪(CVD)化疗后,患者出现显著肿瘤缩小及症状完全缓解。本病例旨在为SDHB突变型副神经节瘤的认知提供更多证据。
病 例
患者男,40 岁,因晕厥、多汗、流涎、无抽搐及大小便失禁于 2022 年 8 月就诊于四川大学华西医院肿瘤中心急诊科。查体可见面部水肿,心率 98 次/分,血压 193/114 mmHg,呼吸频率 20 次/分,体重指数 24.2 kg/m²,ECOG评分 2 分。1 小时后,患者意识逐渐恢复。此次事件发生前约 7 个月,患者开始出现夜间反复低血糖;过去 6 个月内,患者反复头痛,发作时自测收缩压超过 180 mmHg。此外,患者无显著个人史、家族史及社会心理病史。血常规、肝肾功能评估、心电图及头颅CT扫描均未发现异常。当血糖为 1.5 mmol/L时,血清胰岛素、C肽、胰岛素样生长因子I(IGF-I)及生长激素(GH)水平均正常(表1)。但胸腹部CT检查发现左侧腹膜后 14.1×9.7 cm肿块及多发肺部病灶(图1A、D、G、J)。患者儿茶酚胺、促肾上腺皮质激素(ACTH)及神经元特异性烯醇化酶(NSE)水平升高(表1),符合转移性副神经节瘤(PGL)诊断。尽管嗜铬细胞瘤/副神经节瘤(PPGL)因儿茶酚胺分泌过多常表现为高血糖,但该患者出现反复低血糖,促使通过病理学进一步明确诊断。此外,影像学显示多发肺转移,排除了根治性手术可能。因此,经讨论活检风险后,患者及家属选择行腹膜后病灶活检。幸运的是,未发生不良反应。免疫组化分析显示突触素(Syn)、嗜铬粒蛋白A(CgA)及生长抑素受体2(SSTR2)阳性,但SDHB及S100阴性(图2),Ki-67标记指数为 60%。二代测序(NGS)显示SDHB基因体细胞拷贝数缺失。进一步行68Ga-DOTATATE及18F-FDG PET-CT,结果显示转移累及肺部及骨骼部位,包括左第 7 肋前段、左肩胛骨及左肱骨(图3)。
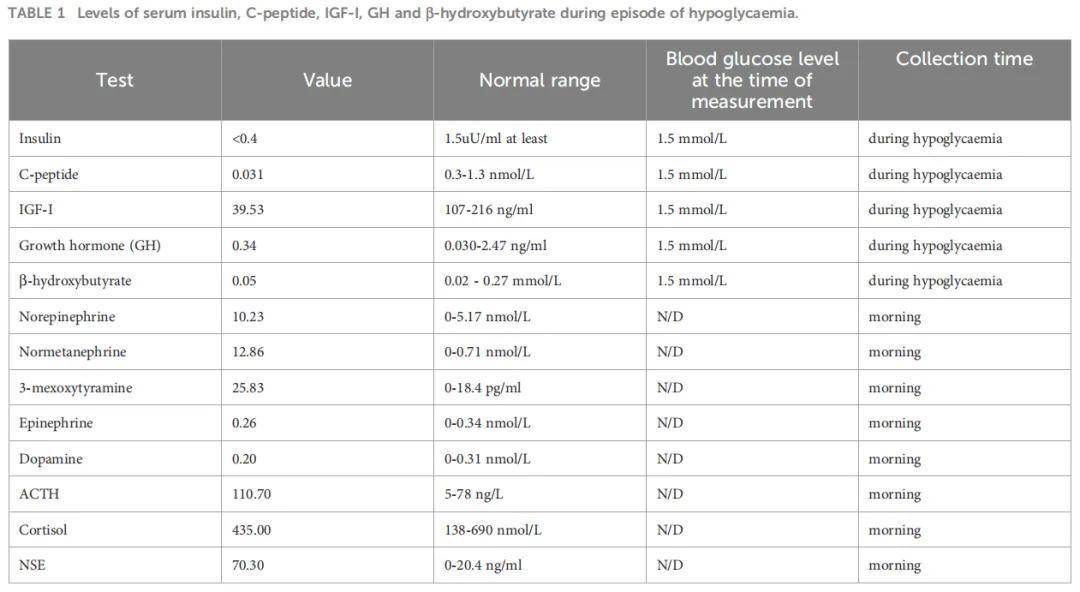
▲图1 低血糖发作期间血清胰岛素、C肽、IGF-I、GH和β-羟基丁酸的水平
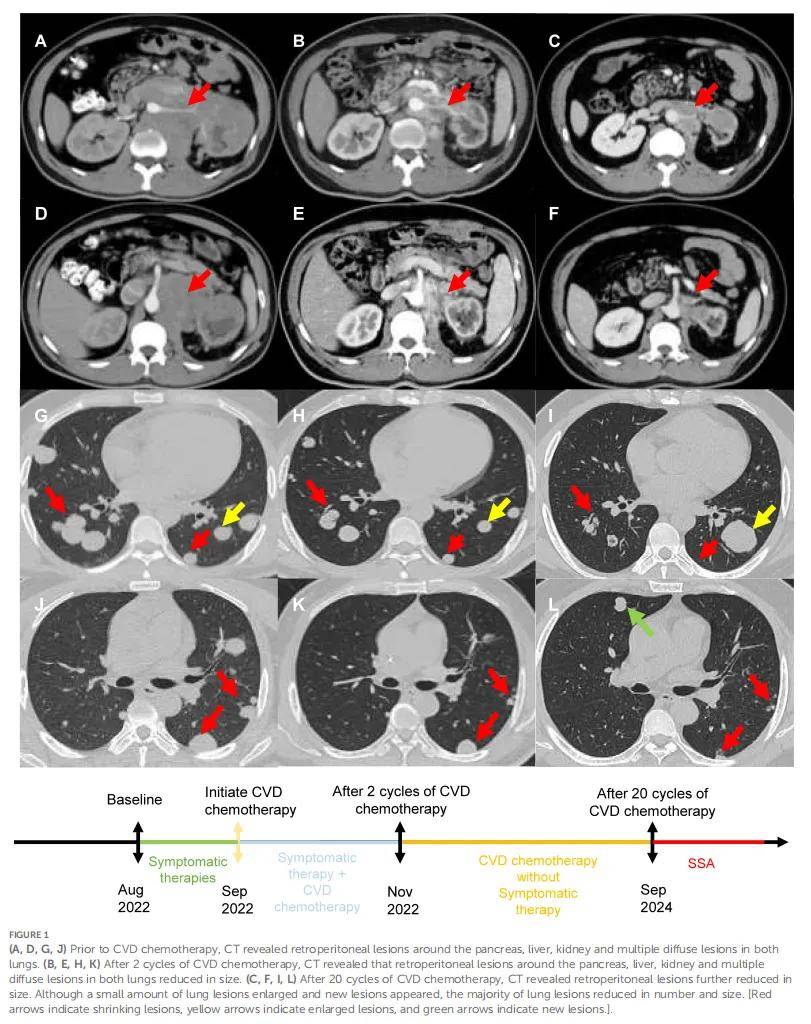
▲图1 CVD化疗前、化疗两个周期后、化疗20个周期后的CT影像
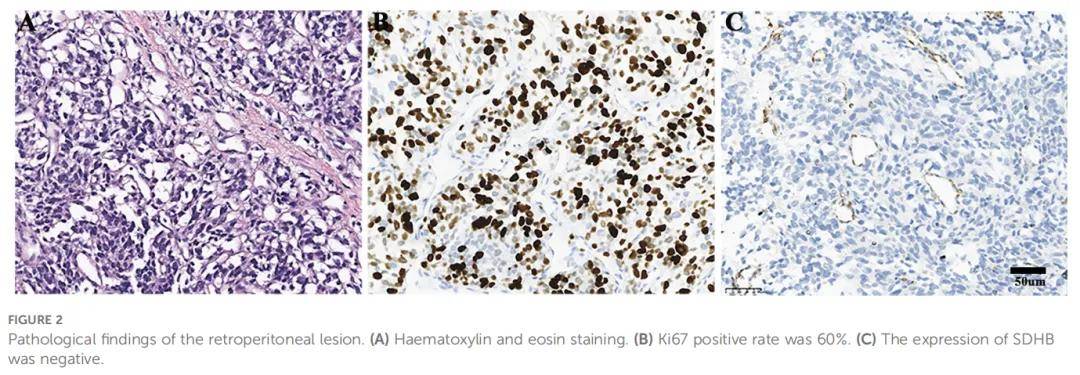
▲图2 腹膜后病变的病理结果
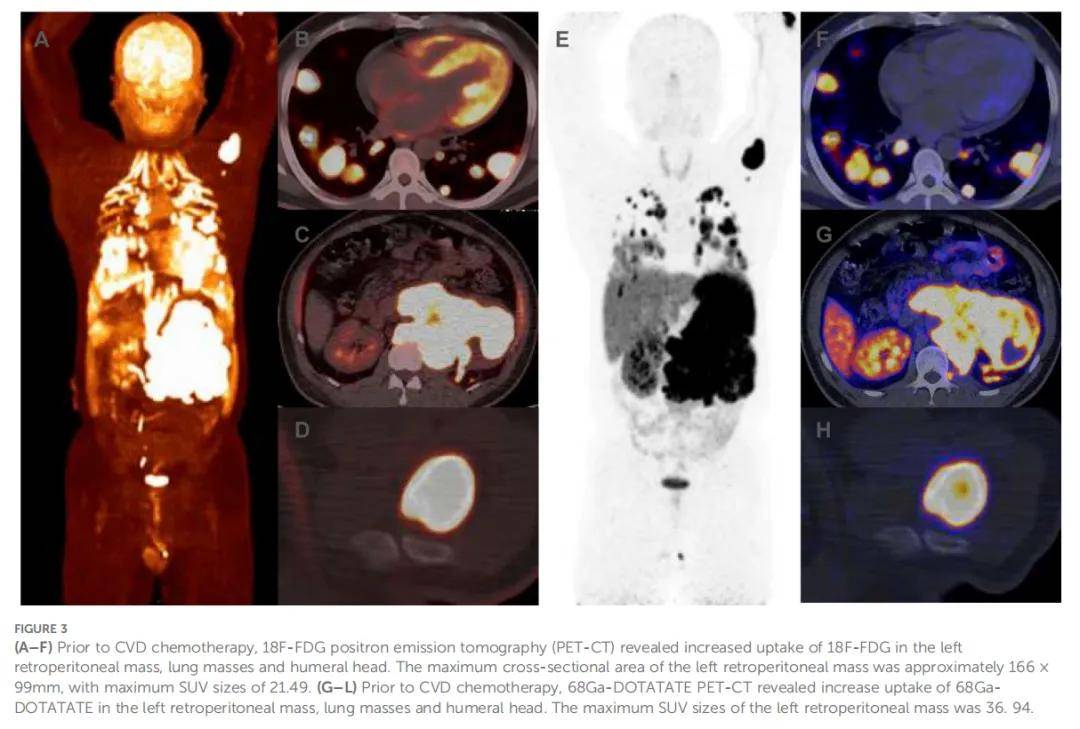
▲图3 CVD化疗前PET-CT结果
尽管接受了包括α受体阻滞剂及静脉补液在内的 1 个月对症治疗,患者仍反复出现低血糖及高血压危象。基于患者出现症状的时间推测,疾病进展迅速。鉴于患者对治疗无反应的状态及肿瘤快速生长,于危急状态下启动化疗。2022 年 9 月开始采用环磷酰胺(1300 mg,第 1 天,每 4 周 1 次)、长春新碱(2 mg,第 1 天,每 4 周 1 次)及达卡巴嗪(1000 mg,第 1-2 天,每 4 周 1 次)联合化疗方案。令人惊喜的是,两个治疗周期后CT扫描显示腹膜后肿块及肺转移灶显著缩小(图1B、E、H、K)。根据实体瘤疗效评价标准1.1版(RECIST 1.1),达到部分缓解(PR)。此外,观察到生化完全缓解及症状消退,患者得以停用对症治疗。神经元特异性烯醇化酶(NSE)及儿茶酚胺水平同步下降。2024 年 9 月CT扫描显示新发肺部病灶且部分肺病灶增大,提示疾病进展;但腹膜后病灶及多数肺病灶体积进一步缩小(图1C、F、I、L)。环磷酰胺-长春新碱-达卡巴嗪(CVD)化疗的无进展生存期(PFS)为 24 个月。鉴于患者生长抑素受体(SSTR)高表达,建议转换为生长抑素类似物(SSA)治疗。目前患者病情稳定,无不适症状及治疗相关不良反应。
讨 论
本病例报告了 1 例 40 岁男性SDHB突变型转移性副神经节瘤(PGL)患者。经环磷酰胺-长春新碱-达卡巴嗪(CVD)化疗后,患者达到了快速、深度且持久的部分缓解(PR)及生化完全缓解。中国患者中SDHB突变型PGL的患病率已有充分文献记载。与其他类型相比,SDHB突变型PGL通常表现为发病早、去甲肾上腺素能或多巴胺能生化表型,且生存期更短。此外,可基于SDHB突变状态制定精准治疗方案。多项研究证实,CVD化疗是SDHB突变型PGL患者的一线治疗。本病例再次印证了上述观点。
在副神经节瘤中,错义突变和截断突变是SDHB突变最常见的报道类型。与错义突变相比,SDHB截断突变通常与嗜铬细胞瘤/副神经节瘤(PPGL)更高的恶性潜能相关。本研究中,患者SDHB突变为拷贝数缺失型,该突变类型在既往研究中报道较少。尽管错义突变和截断突变常导致关键蛋白生物学功能完全丧失,但拷贝数缺失通常表现为基因表达量降低,引起部分功能缺失。此类突变是否与患者更优的预后相关,仍需大规模临床研究验证。
值得注意的是,SDHB突变与免疫组化SDHB阴性表达并不等同。免疫组化SDHB表达缺失常被用作评估SDHx基因突变的替代标记。这种方法不仅成本效益高,还有助于识别基因检测的假阴性结果。然而,研究人员认为免疫组化SDHB阴性表达无法替代二代测序。多项研究表明,SDHx基因不同突变常表现出不同的临床表现,这对患者预后及治疗具有重要意义。因此,研究人员强调在临床实践中结合基因检测与免疫组化分析对精准诊断及预后评估的重要性。
由于儿茶酚胺的升糖作用,副神经节瘤直接诱导的低血糖极为罕见。我们通过文献复习总结了该低血糖可能的四种机制:其一为肿瘤自身免疫性低血糖,常与骨髓瘤、霍奇金病相关;其二为肝、肾上腺或垂体功能不全导致的低血糖;其三为肿瘤负荷过大引起葡萄糖快速消耗,进而导致低血糖;其四为肿瘤分泌胰岛素样生长因子II(IGF-II)、胰岛素样生长因子I(IGF-I)及生长激素(GH)等降糖物质引发低血糖。本病例中,肿瘤自身免疫性低血糖相关抗体、肝功能、肾上腺功能及垂体功能均正常,故排除前两种机制。鉴于患者肿瘤负荷大且随肿瘤缩小低血糖改善,推测后两种机制可能参与其中。快速生长的肿瘤消耗葡萄糖并释放降糖物质,导致这一罕见并发症。然而,受技术限制及当前认知水平影响,我们遗憾未检测低血糖发作时的血清IGF-II水平。因此,研究人员仅能推测该低血糖的原因可能为多因素。
综上,本研究报告了 1 例罕见的SDHB突变型转移性副神经节瘤(PGLs)病例,其对环磷酰胺-长春新碱-达卡巴嗪(CVD)化疗表现出快速、深度且持久的反应。研究强调了SDHB突变在影响副神经节瘤预后及治疗选择中的关键作用。
我司实体瘤1299基因检测、实体瘤272基因检测PLUS项目均覆盖SDHB基因全编码区(CDS),辅助诊断、预后评估、靶向用药、免疫用药、化疗及遗传风险评估,满足临床精准诊疗需求。
参考文献:
Zhang C, Wei Y, Cheng K and Cao D (2024) Durable and deep response to CVD chemotherapy in SDHB-mutated metastatic paraganglioma: case report. Front. Endocrinol. 15:1483516. doi: 10.3389/fendo.2024.1483516




