在探讨大脑健康与全身性慢病的关系时,一个逐渐清晰的科学图景显示,血管系统的状态与认知功能的维持存在深刻联系。高血压与高血脂,作为常见的血管风险因素,其影响范围可能远超心血管系统本身。
从病理生理学的连续进程来看,高血压与高血脂对大脑的潜在威胁始于对微小血管的损害。长期升高的血压对血管内皮产生持续的剪切应力,导致内皮功能紊乱。与此同时,异常的血脂谱,特别是低密度脂蛋白胆固醇的升高,会促进脂质在血管壁沉积。这两种过程协同作用,共同加速脑内小动脉的玻璃样变和粥样硬化。这些微观血管的病变,直接后果是大脑白质区域慢性、弥漫性的低灌注。白质由大量神经纤维束构成,负责连接不同脑区以实现高效的信息传递。慢性缺血会损害包裹神经纤维的髓鞘,如同电线绝缘层破损,导致神经信号传导速度减慢、效率降低,这是认知功能下降的早期结构性基础之一。

1血脑屏障的完整性受损
血管病变的下一阶段影响,涉及大脑的关键保护结构——血脑屏障。血脑屏障由紧密连接的内皮细胞、星形胶质细胞终足和周细胞共同构成,严格调控血液与脑组织之间的物质交换。高血压的机械压力和血脂异常引发的炎症反应,会削弱内皮细胞间的紧密连接,并导致周细胞功能丧失。其直接后果是血脑屏障的通透性增加。这使得血液中原本被阻挡的物质,如血浆蛋白、炎性细胞因子,甚至微量的血源性毒素,得以渗入脑实质。这些外来物质会激活大脑固有的免疫细胞——小胶质细胞,使其进入持续的、低水平的炎症反应状态,这种慢性神经炎症环境对神经元具有毒性。

更为关键的是,受损的血脑屏障也影响了脑内代谢废物的清除效率。大脑在活动过程中会产生诸如β-淀粉样蛋白等代谢副产品。一个健康的脑内存在一套被称为“类淋巴系统”的清除通路,依赖脑脊液的流动和血管周围的间隙来有效清除这些废物。当血管壁增厚、弹性下降,血管周围间隙的功能随之紊乱,导致类淋巴系统清除能力下降。这并非直接“产生”更多的异常蛋白,而是造成了 异常蛋白的生成与清除之间的动态平衡被打破,为蛋白质的异常聚集创造了条件。
2能量代谢危机与神经元功能障碍
大脑是人体能量消耗出众的器官,其正常功能极度依赖持续、充足的氧气和葡萄糖供应。高血压和高血脂引发的血管狭窄与硬化,使得大脑长期处于一种“能量边缘”状态。神经元和突触在传递信息、维持可塑性时需要消耗大量能量。当能量供应受限时,神经元会优先保障基本的生存功能,而削弱那些与高级认知活动相关的“高耗能”过程,例如长时程增强效应,这是学习和记忆形成的细胞基础。
此外,胰岛素抵抗现象不仅存在于外周组织,同样可能发生在大脑中。高血脂和炎症环境会干扰大脑神经元对胰岛素的反应。脑内胰岛素信号通路不仅参与调节血糖,更在神经元存活、突触可塑性和记忆巩固中扮演重要角色。该通路的信号转导效率下降,会直接影响海马体等关键脑区的功能,而这些区域对于形成新的记忆至关重要。
3从血管损伤到认知衰退的临床关联
流行病学与神经影像学研究为此病理链条提供了实证支持。长期追踪研究发现,中年时期未经有效管理的高血压,与晚年出现更显著的脑白质高信号体积增大相关,后者在磁共振影像上表现为白质区域的亮点,是缺血性损伤的标志。同样,中年期的高胆固醇水平是预测二十年后认知测试分数下降的独立风险因素。
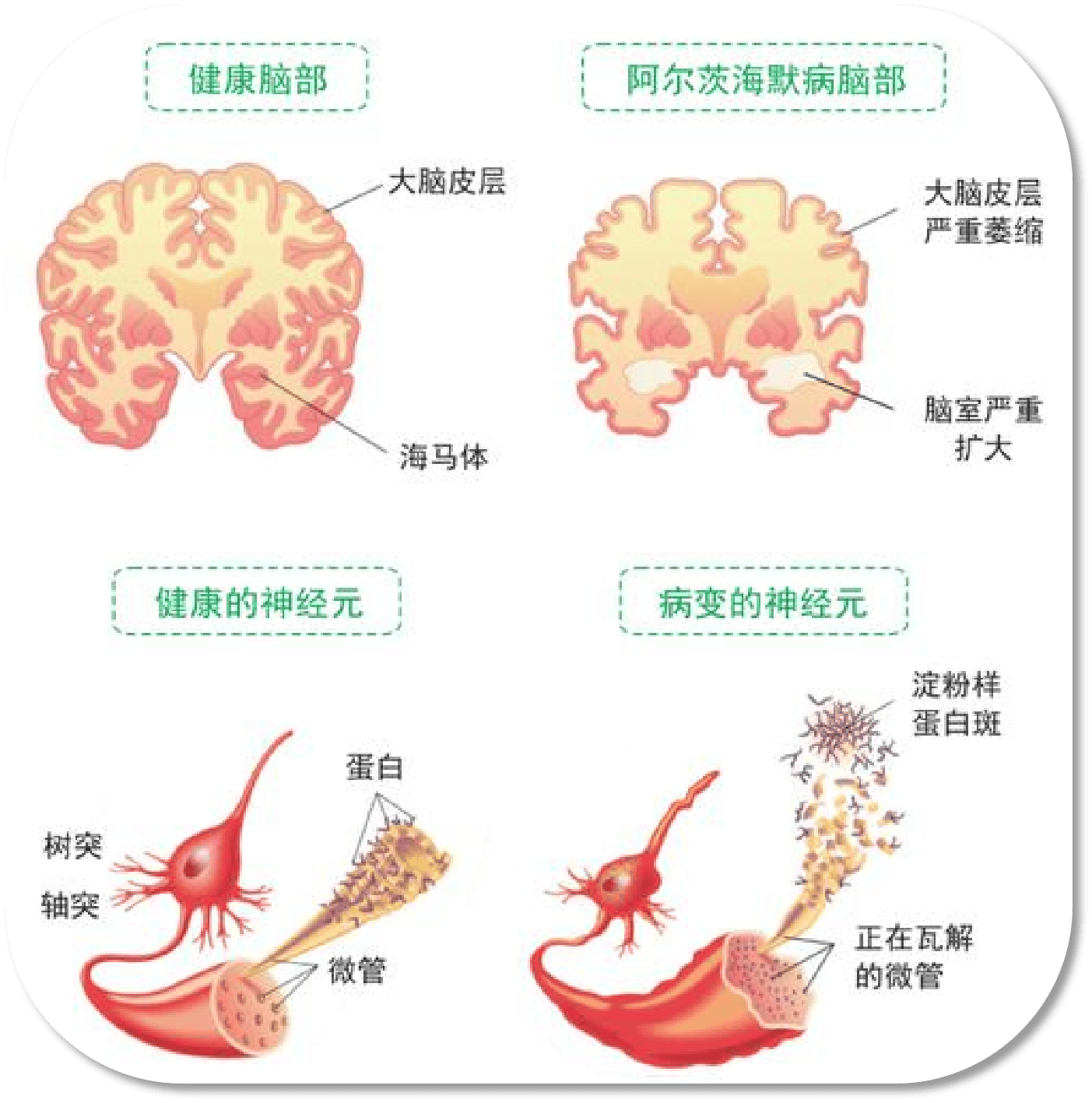
在临床诊断的认知障碍谱系中,存在一种被称为“血管性认知障碍”的类型,其认知损害可直接归因于脑血管病变。然而,更多的情况是混合性的病理改变。尸检研究揭示,许多存在阿尔茨海默病典型病理改变(如淀粉样斑块和神经原纤维缠结)的大脑,也同时伴有不同程度的脑血管病变。这两种病理过程并非独立存在,而是存在相互作用:血管病变导致的缺血、炎症和血脑屏障破坏,可能加剧阿尔茨海默病相关蛋白质的沉积和神经毒性;反之,阿尔茨海默病病理也可能进一步损害脑血管功能。这种相互作用使得认知衰退的进程加速。
基于上述机制,干预血管风险因素对于维护认知健康具有明确的科学依据。其价值不仅在于预防纯粹的脑血管事件,更在于改善大脑的整体内环境。将血压维持在平稳、适宜的范围内,有助于保障稳定的脑血流灌注,减轻血管壁的机械损伤。通过饮食调整等方式改善血脂谱,旨在降低血管的炎症负荷和动脉粥样硬化风险。规律的身体活动被证实可以促进脑血管的健康、增强脑内能量代谢效率,并可能间接辅助类淋巴系统的废物清除功能。
综合现有证据,高血压与高血脂对大脑的影响是一个多环节、渐进性的生物学过程。它从损害微血管结构与功能开始,逐步波及血脑屏障的完整性,干扰脑内废物清除,引发慢性炎症,并最终导致神经元能量危机与功能障碍。这一过程清晰地表明,对血管风险因素的管理,其意义便捷了心血管系统保护的范畴,是维护大脑长期健康、支持认知功能储备的重要组成部分。认识到这种全身性与脑部健康的深刻联系,为通过管理可控风险因素来支持脑健康提供了科学视角。





