肠道是人体消化系统的“主干道”,而肠息肉就像是这条道路上悄悄生长的“小疙瘩”。
很多人拿到肠镜报告时都会疑惑:
这些息肉都是一样的吗?
哪些会癌变?
要不要马上切掉?
今天我们就用一张“息肉地图”,帮你理清不同肠息肉的特点、癌变风险和应对方案。
一、肠息肉的“家族图谱”:四大类型各有特点
肠息肉并非单一疾病,而是多种肠道黏膜隆起性病变的统称。
根据病理特征和癌变风险,主要分为以下四类:
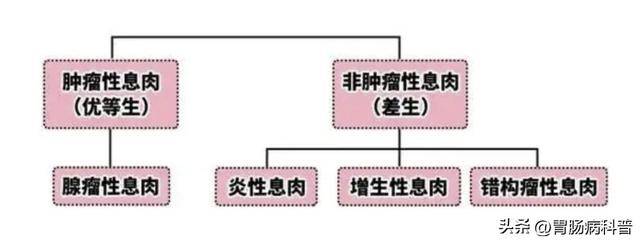
1. 腺瘤性息肉:“癌前病变”的主力军
- 占比:约占肠息肉的60%~70%,是公认的“癌前病变”。
- 特点:由肠道黏膜腺上皮异常增生形成,分为管状腺瘤、绒毛状腺瘤、管状绒毛状腺瘤三种亚型。
- 癌变风险:
- 管状腺瘤(最常见):直径<1cm时癌变率约1%~5%,直径>2cm时升至20%~30%;
- 绒毛状腺瘤(“高危分子”):癌变率高达30%~70%,且直径越大风险越高;
- 管状绒毛状腺瘤:癌变率介于两者之间(约10%~25%)。
- 典型表现:多为单发,表面光滑或分叶状,颜色与周围黏膜相近或略发红。
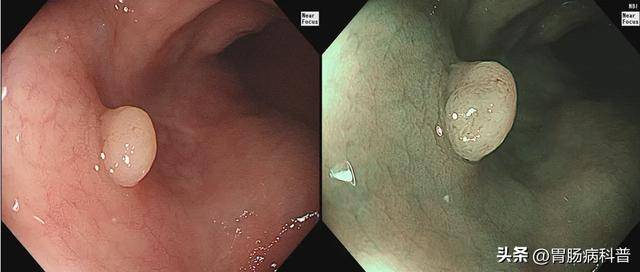
图1 结肠管状腺瘤,腺管呈III L型
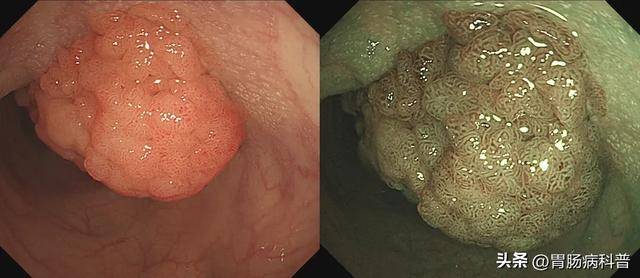
图2.结肠绒毛管状腺瘤,腺管呈IV型,高级别内瘤变
2. 炎性息肉:“炎症刺激的临时工”
- 占比:约占20%~30%,常继发于溃疡性结肠炎、克罗恩病等肠道炎症。
- 特点:炎症导致黏膜修复过程中过度增生形成,本质是“良性疤痕”。
- 癌变风险:极低(<1%),但若长期炎症刺激不控制,可能进展为腺瘤性息肉。
- 典型表现:多发,直径较小(多<0.5cm),形态扁平,常伴肠黏膜充血水肿。
- 占比:约占10%~20%,多见于中老年人和左半结肠。
- 特点:肠道黏膜细胞自然老化、增生形成,与饮食、年龄相关。
- 癌变风险:几乎为零,但直径>1cm时需警惕合并腺瘤性成分。
- 典型表现:微小(多<0.5cm),表面光滑,散在分布于直肠和乙状结肠。
- 占比:<5%,包括Peutz-Jeghers综合征(PJS)、幼年性息肉等。
- 特点:由正常组织异常排列形成,与基因突变相关(如STK11基因)。
- 癌变风险:PJS患者息肉癌变率高达30%~50%,需密切监测;幼年性息肉多为良性。
- 典型表现:PJS息肉多为错构瘤性,伴口唇、手指黑色素沉着;幼年性息肉多见于儿童,易出血。
根据《中国结直肠癌筛查与早诊早治指南(2023)》,不同息肉的癌变风险可归纳为“三梯队”(此处可插入息肉癌变风险对比表):
管状绒毛状腺瘤
息肉类型 |
癌变风险等级 |
关键高危因素 |
建议处理方式 |
绒毛状腺瘤 |
★★★★★ |
直径>2cm、广基、伴重度异型增生 |
立即内镜下切除,术后1~3年复查 |
★★★★☆ |
|||
直径>1.5cm、绒毛成分>25% |
内镜下切除,术后2~3年复查 |
||
管状腺瘤(>1cm) |
★★★☆☆ |
直径>1cm、表面糜烂、家族病史 |
内镜下切除,术后3年复查 |
炎性/增生性息肉 |
★☆☆☆☆ |
直径<1cm、无不适症状 |
无需切除,定期观察(5~10年) |
错构瘤性息肉(PJS) |
★★★★☆ |
多发息肉、伴家族史 |
手术切除+基因检测,每年肠镜监测 |
划重点:腺瘤性息肉(尤其是绒毛状腺瘤)是肠癌的主要“前身”,从息肉发展到浸润性肠癌通常需要5~10年,这为早期干预提供了宝贵窗口期。
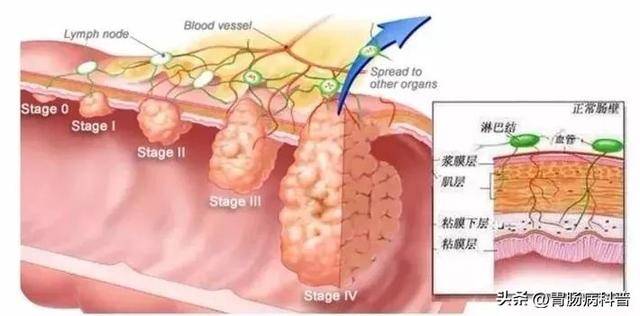
三、哪些息肉必须“斩草除根”?医生给出4条“切除红线”
并非所有息肉都需要立即切除,但出现以下情况时,医生会建议积极干预(此处可插入肠镜下息肉切除示意图):
1. 病理类型为腺瘤性息肉
无论大小,原则上均建议切除。因为即使是1cm的管状腺瘤,也有1%~5%的癌变可能,且无法完全排除“漏诊”的高危成分。
2. 满足任一“高危特征”
- 直径≥1cm;
- 病理提示“高级别上皮内瘤变”(即重度异型增生);
- 广基息肉(无蒂,基底宽大);
- 合并出血、腹痛等症状。
- 有肠癌或腺瘤性息肉家族史者(尤其是一级亲属在50岁前发病);
- 患有遗传性息肉病(如家族性腺瘤性息肉病FAP,患者结直肠可长数百个息肉,40岁前癌变率近100%);
- 炎症性肠病(如溃疡性结肠炎)患者,需定期切除“癌前息肉”以预防癌变。
- 原小息肉短期内迅速增大(如6个月内直径翻倍);
- 息肉表面从光滑变为粗糙、糜烂或出现溃疡;
- 复查肠镜时发现新发息肉,且病理提示为腺瘤性。

图3 肠镜检查结果
四、科学应对:从“发现息肉”到“阻断癌变”的全流程 1. 第一步:精准诊断,明确“身份”
肠镜是发现息肉的“金标准”,但仅靠肉眼难以判断性质,因此所有息肉切除后都必须送病理检查,明确是腺瘤性、炎性还是其他类型。
2. 第二步:个性化治疗,该切则切
- 内镜下切除:适用于大多数息肉(如EMR内镜黏膜切除术、ESD内镜黏膜下剥离术),创伤小、恢复快;
- 外科手术:仅用于巨大息肉(>3cm)、内镜下无法切除或已恶变的息肉。
息肉切除后并非一劳永逸,需根据病理类型和风险分层制定复查计划:
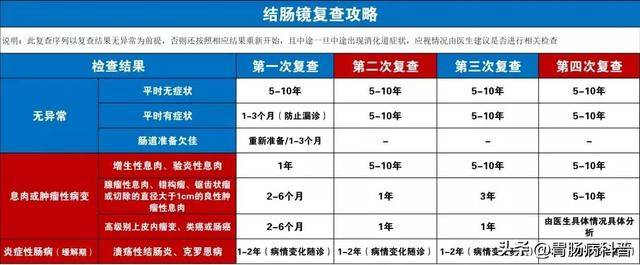
- 低危腺瘤(1~2个管状腺瘤,直径<1cm):术后3~5年复查肠镜;
- 高危腺瘤(3~4个腺瘤、任一腺瘤直径>1cm、绒毛状腺瘤):术后1~3年复查;
- 炎症性/增生性息肉:5~10年复查;
- 遗传性息肉病:每1~2年复查,必要时行预防性结肠切除。
- 饮食“三少三多”:少红肉(猪牛羊肉)、少加工肉(香肠、培根)、少高脂食物;多膳食纤维(全谷物、蔬菜)、多钙和维生素D(牛奶、深海鱼)、多抗氧化食物(蓝莓、西兰花)。
- 控制体重+规律运动:肥胖(BMI>28)是息肉独立危险因素,建议每周至少150分钟中等强度运动(如快走、游泳)。
- 戒烟限酒:吸烟可使息肉风险增加30%,酒精会损伤肠黏膜,建议男性每日酒精摄入<25g(约1两白酒),女性<15g。
总结:肠息肉并非“一刀切”的问题,关键是通过肠镜明确类型、评估风险。记住:腺瘤性息肉是“定时炸弹”,发现后及时切除可阻断癌变;炎性/增生性息肉多为“良性过客”,定期观察即可。从40岁起定期做肠镜筛查(有家族史者提前至30岁),是守护肠道健康最有效的“保险单”。
(注:数据来源参考《中国结直肠癌筛查与早诊早治指南(2023)》《Gastroenterology》等权威期刊。)





