【导读】鉴于肿瘤微环境(TME)的异质性,新辅助免疫治疗联合化疗仅对部分肺腺癌(LUAD)患者有益,且耐药机制尚不清楚。
8月25日,复旦大学研究团队在期刊《Cell Death Discovery》上发表了研究论文,题为“Tumor-derived exosomal tsRNA 3′tiRNA-AlaCGC in promoting fibroblast senescence and Galectin-9 secretion to induce immune tolerance in lung adenocarcinoma”,本研究中,研究人员通过分析发现 LUAD 患者对新辅助治疗耐药的肿瘤中 3'tiRNA-AlaCGC 表达升高,并且与 LUAD 患者的不良预后呈负相关。此外,研究人员发现携带 3'tiRNA-AlaCGC 的肿瘤来源外泌体通过抑制 FOXO3 并激活 TGF-β/Smad3 通路靶向成纤维细胞,诱导衰老相关分泌表型(SASP),并增加半乳凝素 -9 的分泌;SASP 和半乳凝素 -9 合成诱导细胞毒性 CD8+ T 细胞功能障碍。体内实验表明,C57BL/6 小鼠肿瘤中 3'tiRNA-AlaCGC 高表达导致 CD8+ T 细胞浸润减少和细胞毒性功能减弱,从而导致抗 PD-L1 治疗耐药。总的来说,本研究强调了 3'tiRNA-AlaCGC 在肺腺癌中的免疫抑制作用,揭示了其分子特征,并有助于个性化治疗策略的制定。

背景知识
01
抗 PD-1 或 PD-L1 单克隆抗体等免疫检查点抑制剂(ICIs)在晚期 LUAD 患者中显示出显著疗效,推动免疫疗法进入新辅助治疗领域。然而,只有少数 LUAD 患者对免疫疗法有显著反应,这影响了预后。探究免疫疗法耐药的分子机制、探索有效的治疗靶点、提高疗效以及改善 LUAD 患者的预后仍迫在眉睫。
3'tiRNA-AlaCGC 的表达在细胞水平上不影响肺腺癌细胞的增殖、迁移和侵袭
02
鉴于 3'tiRNA-AlaCGC 与肺腺癌(LUAD)患者对免疫治疗反应不佳及预后不良相关,为确定其是否影响 LUAD 的生物学行为,研究人员通过细胞实验进一步验证了这一点。研究结果表明,3'tiRNA-AlaCGC 不同的表达水平对 A549 和 H1299 细胞的增殖能力均无显著影响。此外,3'tiRNA-AlaCGC 的表达也不影响 A549 和 H1299 细胞的迁移和侵袭能力。
为了在体内验证 3'tiRNA-AlaCGC 对肺腺癌(LUAD)的影响,研究人员将不同类型的 A549 细胞皮下注射到裸鼠体内,以形成皮下肿瘤。与上述结果一致,三组裸鼠的肿瘤大小也没有显著差异。因此,本数据表明,3'tiRNA-AlaCGC 既不影响 LUAD 细胞在体外的增殖、迁移和侵袭能力,也不影响免疫缺陷条件下体内的肿瘤形成。
3'tiRNA-AlaCGC 抑制 CD8+ T 细胞的细胞毒性,并在体内增强抗 PD-L1 免疫疗法敏感性
03
鉴于 3'tiRNA-AlaCGC 在肿瘤细胞中的上调对 CD8+T 细胞功能有显著影响,研究人员进一步研究了肿瘤细胞中 3'tiRNA-AlaCGC 的表达是否会在体内损害 CD8+T 细胞的细胞毒性和免疫治疗反应性。结果表明,在免疫功能正常的实验小鼠中,3'tiRNA-AlaCGC 过表达的肿瘤细胞与对照组相比增殖显著增强。在抗 PD-L1 治疗后,LLC-NC 组的肿瘤明显缩小,而模拟组的肿瘤缩小程度很小。因此,可以推断肿瘤细胞中存在 tsRNA 会导致免疫治疗耐药。
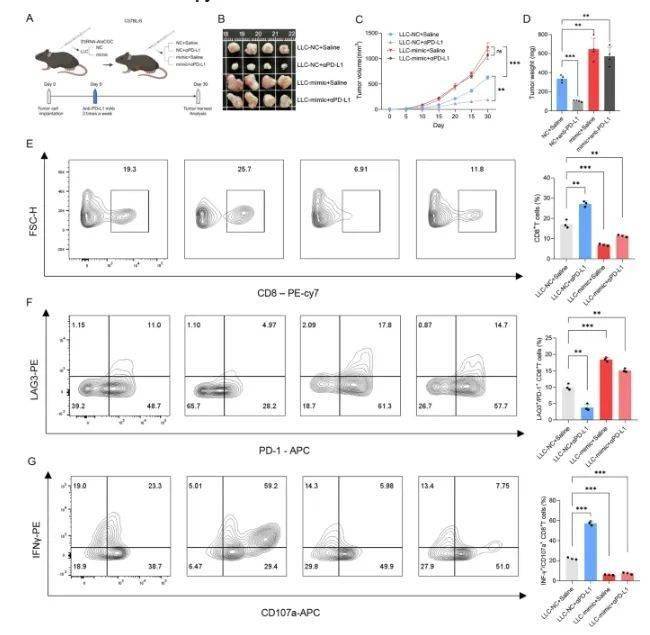
3'tiRNA-AlaCGC抑制体内 CD8 + T 细胞的细胞毒性并增强抗 PD-L1 免疫疗法的敏感性
后续的流式细胞术分析表明,在肿瘤细胞中过表达 3'tiRNA-AlaCGC 导致肿瘤浸润 CD8+T 细胞的比例降低。此外,在抗 PD-L1 免疫治疗后,NC 组肿瘤内 CD8+T 细胞浸润显著增加,而模拟组则不然。对这些 CD8+T 细胞的功能评估表明,3'tiRNA-AlaCGC 过表达显著抑制了它们的细胞毒性能力。
结论
04
综上,研究人员发现 3'tiRNA-AlaCGC 的表达与免疫治疗耐药性相关。从机制上看,肺腺癌采用了一种新的免疫耐受机制来对抗免疫治疗,通过外泌体中的 3'tiRNA-AlaCGC 调节成纤维细胞衰老和半乳凝素 -9 的分泌。
参考资料:
【关于投稿】




