小细胞肺癌(SCLC)是一种高级别神经内分泌恶性肿瘤,预后不良,约占全球肺癌病例的15%。基因图谱研究的进展表明,SCLC是一种分子异质性疾病,根据其神经内分泌和免疫相关特征,可分为SCLC-A、SCLC-N、SCLC-P和SCLC-I等亚型。这种异质性凸显了量身定制治疗策略的必要性。
大细胞神经内分泌癌(LCNEC)与SCLC在组织学和分子层面存在相似之处,但仍是一种独特的疾病实体。LCNEC主要分为两种亚型:Ⅰ型,以STK11和KEAP1突变以及神经内分泌表型为特征;Ⅱ型,以TP53和RB1变异以及较高的增殖指数为特征。LCNEC的罕见性及其分子多样性给标准化治疗带来了挑战,这进一步凸显了与SCLC进行对比研究的必要性。
在本综述中,研究者重点介绍SCLC和LCNEC的基因及临床病理特征。此外,研究者还将探讨SCLC和LCNEC治疗领域的新兴疗法及未来发展方向。
研究背景
世界卫生组织(WHO)对胸部恶性肿瘤的分类将主要的神经内分泌(NE)肿瘤分为四类:典型类癌、非典型类癌、SCLC和LCNEC。
最常见的胸部神经内分泌肿瘤是SCLC,这是一种神经内分泌恶性肿瘤,主要发生在吸烟人群中,且预后不良。约15%的新诊断肺癌病例为小细胞肺癌,全球范围内,SCLC每年新增病例约25万例,死亡约20万例。从历史上看,SCLC在男性中更为常见,但在过去50年里,女性病例的比例有所上升,这反映了烟草消费的趋势。在全球范围内,SCLC的发病率在20世纪80年代达到顶峰,但在过去30年里一直在下降。
第二常见的胸部神经内分泌肿瘤是LCNEC,约占新诊断肺癌病例的3%。SCLC和LCNEC均为高分级肿瘤,预后不良。LCNEC被认为是胸部神经内分泌癌的一种罕见亚型,因此,临床数据匮乏,难以制定标准的治疗方案。
本综述将讨论SCLC和LCNEC的分子和基因谱。接下来,研究者将阐述SCLC和LCNEC在治疗方面未被满足的需求。最后,研究者将探讨目前正在积极研究的新兴疗法。
SCLC的诊断
SCLC的病理诊断主要依靠对组织标本的组织学评估。在低倍镜下,显微镜检查通常可见蓝色病灶,这表明存在核质比高的小细胞。肿瘤细胞的大小通常小于三个静止淋巴细胞的直径,但部分亚群的细胞大小可能大于三个淋巴细胞,这可能使其难以与大细胞神经内分泌癌区分开来。
免疫组织化学
免疫组织化学有助于确认小细胞肺癌的诊断,并排除其他恶性小圆形细胞肿瘤。当怀疑为小细胞癌时,通常会使用神经内分泌标志物,如嗜铬粒蛋白、突触素或CD56,可单独使用,也可联合使用。在这些标志物中,嗜铬粒蛋白的敏感性最低,而CD56的敏感性最高,但特异性较低。细胞角蛋白染色可确认癌的诊断,核周点状模式是小细胞癌的特征。已知80%以上的病例表达TTF-1,通常在神经内分泌高表达的肿瘤中,而INSM-1已被报道为神经内分泌分化的有用标志物。
SCLC与LCNEC的鉴别诊断
WHO 2021年版肺神经内分泌肿瘤分类包括四种组织学类型:高级别小细胞肺癌、大细胞神经内分泌癌、低级别典型类癌和中级别非典型类癌。根据WHO指南,大细胞神经内分泌癌的明确诊断需要切除的标本,而小活检或细胞学样本应标记为“可能的大细胞神经内分泌癌”,除非其典型的组织学和免疫组织化学特征明显可见。
这些肿瘤可以通过苏木精-伊红染色、评估有丝分裂率、坏死的存在及模式以及核质比来区分。
大细胞神经内分泌癌被定义为高级别神经内分泌癌的一种亚型。其特征是具有类似神经内分泌肿瘤的生长模式,如小梁状、外周栅栏状和玫瑰花结状等。然而,其细胞学特征与非小细胞肺癌相似。因此,需要借助突触素、嗜铬粒蛋白或CD56等神经内分泌标志物的表达来将大细胞神经内分泌癌与其他类型的非小细胞肺癌区分开来。有时,由于两者在细胞学结构上存在重叠,区分大细胞神经内分泌癌和小细胞肺癌可能具有挑战性。对于同时存在明确的小细胞肺癌和占主导地位的大细胞神经内分泌癌的病例,可以考虑诊断为小细胞肺癌与大细胞神经内分泌癌混合型(表1)。
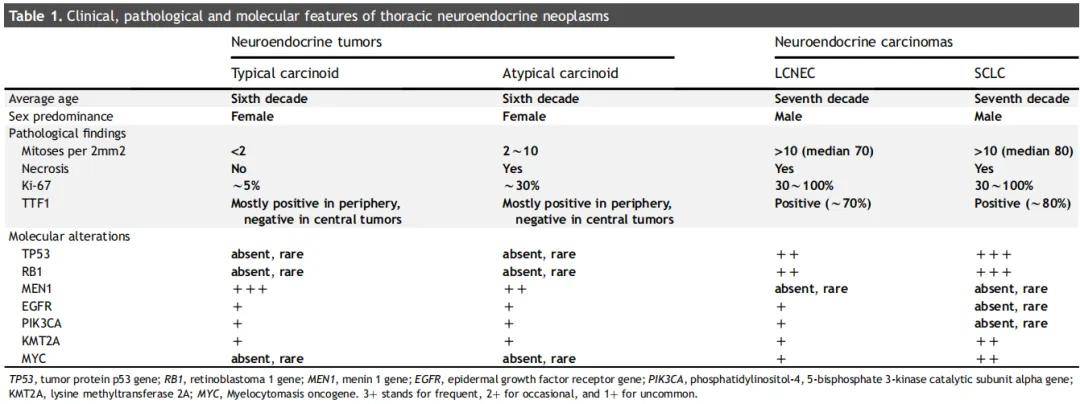
表1
SCLC的基因组图谱
SCLC的基因突变谱已明确吸烟与小细胞肺癌癌变之间的关联。针对SCLC分子异常的研究发现,最常见的基因变异包括TP53(约90%)、RB1(约70%)、KMT2D(约13%)、PIK3CA(约7%)、NOTCH1(约6%)和EGFR(约4%)。
TP53与RB1:
SCLC几乎普遍存在p53和RB1的失活突变,这对SCLC的癌变至关重要。与非小细胞肺癌相比,SCLC的有丝分裂活性和转录活性更高。RB1和p53在调控细胞周期进程中均发挥关键作用:p53是多个检查点的重要细胞周期抑制剂,而RB1是S期进入的主要抑制剂。
KMT2D:
KMT2D是一种组蛋白甲基转移酶,在小细胞肺癌中常发生失活(8%至14%)。KMT2D通过正向调控抑癌基因(如Per2)发挥表观遗传抑癌作用。值得注意的是,KMT2D诱导的Per2表达可抑制促肿瘤糖酵解相关基因,而药物抑制糖酵解能抑制KMT2D突变型肺癌的生长。事实上,糖酵解增强是通过磷酸戊糖途径(与糖酵解相关联的通路,对癌细胞的转录活性至关重要)为DNA复制提供核苷酸所必需的。
NOTCH1:
NOTCH信号通路与神经内分泌分化和化疗耐药密切相关。它是复发性SCLC患者从免疫检查点抑制剂(ICI)中获益的潜在预测指标。RNA测序数据显示,NOTCH信号增强与神经内分泌分化减弱及免疫相关通路激活相关。这一发现在纳武利尤单抗一线治疗SCLC的研究中得到了证实。
MYC
MYC扩增是SCLC的一个亚型特征。在复发性SCLC中,MYC旁系同源物是化疗耐药的已知驱动因素。例如,化疗诱导的DNA损伤主要集中在MYC低表达的肿瘤细胞中,而几乎所有MYC高表达的细胞均未受影响。此外,已知MYC可激活NOTCH信号通路,促进去分化的SCLC从神经内分泌亚型向非神经内分泌亚型转变。这种转变可能导致SCLC的分子异质性,并促使耐药肿瘤的出现。
SCLC的亚型
尽管SCLC具有分子和临床异质性,但针对小细胞肺癌患者的临床试验在很大程度上仍以未筛选人群为研究对象。历史上,SCLC的分类基于神经内分泌转录因子ASCL-1(SCLC-A)和NEUROD1(SCLC-N)的表达。第三种转录因子POU2F3被新定义为SCLC的非神经内分泌亚型(SCLC-P)。然而,许多SCLC肿瘤并不属于这三类。有研究提出以转录因子YAP-1的表达定义第四种亚型,以进一步对小细胞肺癌进行分类,但随后的免疫组织化学(IHC)研究未能证实存在明确的YAP1亚型。有趣的是,最近一项研究表明,表达YAP-1的SCLC细胞系具有与SMARCA4缺陷型恶性肿瘤一致的特征,而不是SCLC。此外,这些亚型是否可预测对化疗和免疫检查点抑制剂的反应仍不明确。一项研究提出了另一种亚型——SCLC-I(炎症型),其特征为ASCL-1、NEUROD1和POU2F3的低表达。SCLC-I的特点是免疫相关基因(如人类白细胞抗原和其他免疫检查点相关基因)的表达增加。值得注意的是,与其他亚型相比,SCLC-I与更高的CD8+ T细胞和巨噬细胞浸润相关,且从免疫检查点抑制剂联合化疗中获益更显著。对IMpower133研究的回顾性分析显示,接受化疗联合阿替利珠单抗治疗的SCLC-I亚组患者的中位OS超过18个月,而化疗联合安慰剂组约为10个月。此外,在SCLC-A和SCLC-N等其他小细胞肺癌亚组中,添加阿替利珠单抗带来更温和的OS获益。SCLC-I可根据神经内分泌特征进一步分为SCLC-I-非神经内分泌型和SCLC-I-神经内分泌型。SCLC-I-神经内分泌型富集免疫抑制性肿瘤相关巨噬细胞,而这一特征在SCLC-I-非神经内分泌型中不太明显。这些结果表明,阿替利珠单抗在SCLC-I-神经内分泌型中的疗效可能优于SCLC-I-非神经内分泌型(图1),但这一观察结果基于回顾性研究,且患者数量有限。最后,除现有亚型外,最近有研究描述了一种非典型小细胞肺癌(aSCLC),其特征为TP53和RB1保持完整,这与典型小细胞肺癌不同。这种罕见亚型主要见于不吸烟者或轻度吸烟者,且存在广泛的染色体碎裂,导致细胞周期相关癌基因(如CCND1、CDK4和MDM2)的染色体外扩增。
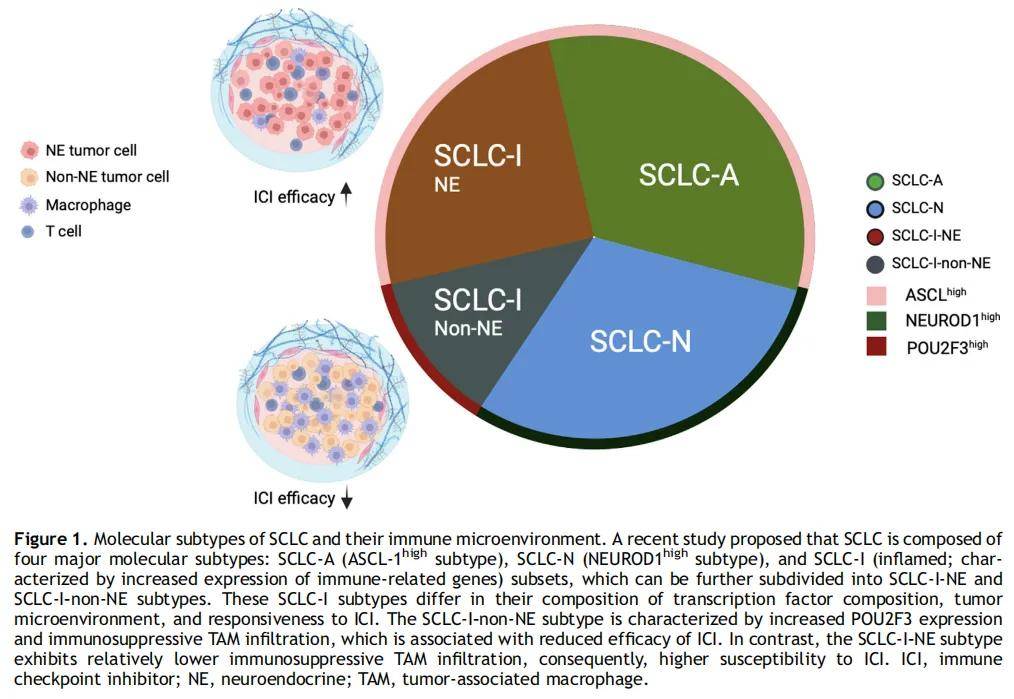
图1
尽管SCLC的分子亚型分类为肿瘤异质性和潜在治疗分层提供了有价值的见解,但这些分类仍处于研究阶段。SCLC肿瘤在不同活检标本之间和单个活检标本内部均表现出显著的异质性,且已有报道称亚型之间存在可塑性。此外,尽管某些亚型似乎更易从免疫检查点抑制剂中获益,但在所有亚组中均观察到了治疗反应。因此,在分子亚型分类能够可靠地用于指导治疗选择之前,还需要在前瞻性临床试验中进一步验证。
LCNEC的基因组图谱与亚型
LCNEC中常见的突变基因包括TP53(约80%)、RB1(约40%)、STK11(约30%)和KEAP1(约31%)。先前的研究将LCNEC分为两种主要亚型,各具有独特的基因变异:Ⅰ型LCNEC,以STK11和KEAP1突变为特征;Ⅱ型LCNEC,以TP53和RB1变异为特征(图2)。
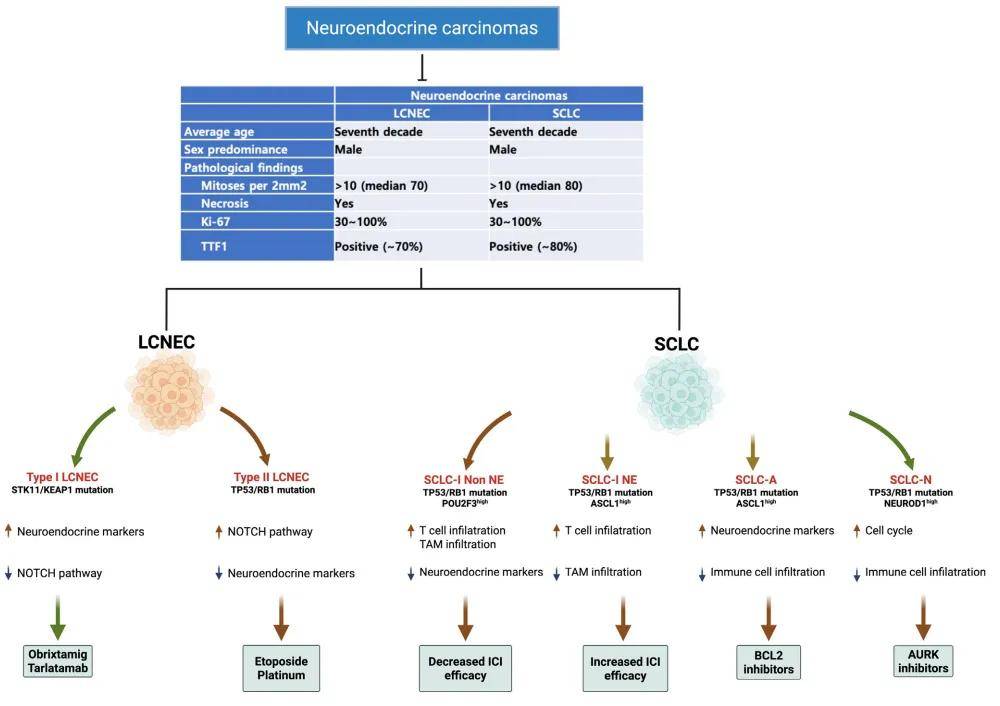

图2
伴有STK11和KEAP1突变的LCNEC:
已知几乎所有缺乏RB1和TP53突变的LCNEC都存在STK11和KEAP1突变,不过部分存在STK11和KEAP1突变的LCNEC也可能携带TP53突变;这一亚群与存在RB1突变的亚群相互排斥。基因集富集分析显示,与氧化磷酸化和三磷酸腺苷合成相关的通路显著富集,而细胞周期相关通路则相对减弱。此外,该亚型高表达NE基因,如CHGA、SYP和DLL3。值得注意的是,无RB1突变的LCNEC亚群对吉西他滨和紫杉烷类化疗的敏感性更高。尽管到目前为止,不同化疗方案对晚期LCNEC的疗效仍存在争议。
DLL3是SCLC中已明确的治疗靶点,它在肿瘤细胞表面高表达,而在正常细胞上几乎不表达或表达极低。近年来,针对该靶点的药物研发成为热点,其中包括双特异性T细胞衔接器(BiTE)。
伴有TP53和RB1突变的LCNEC:
该亚群除NE特征外,与SCLC有许多相似之处,表现为神经内分泌标志物水平降低,且NOTCH通路活性增强。在基因组层面,它与SCLC相似,存在MYCL1、SOX2和FGFR1的扩增。与伴有STK11和KEAP1突变的LCNEC相比,这类肿瘤的增殖指数更高,形态上与SCLC更接近。
临床未满足需求:SCLC与LCNEC的治疗
50%至70%的LCNEC患者在确诊时已发生转移。LCNEC的生存结局与SCLC相似,因此显著差于其他类型的NSCLC。
对于早期肺LCNEC(Ⅰ-Ⅲ期)患者,手术联合辅助化疗被视为一线治疗方案,多项回顾性研究表明,接受手术联合化疗的患者5年OS优于单纯手术的患者。通常采用以铂类为基础的化疗,联合伊立替康或依托泊苷。一项前瞻性随机Ⅲ期研究显示,这两种方案在3年无复发生存率方面无显著差异(p=0.619)。
然而,转移性LCNEC的一线治疗仍存在争议,由于该病相对罕见,缺乏大型前瞻性临床试验。有研究表明,SCLC样方案(如铂类联合依托泊苷)优于NSCLC样方案(如铂类联合培美曲塞)。相反,另一项研究则指出,NSCLC样方案可能比SCLC样方案更有效。这些发现凸显了在LCNEC治疗中,基于生物标志物制定治疗决策的必要性。此前的一项研究报道,具有野生型RB1的LCNEC患者接受吉西他滨联合紫杉烷治疗时,总生存期显著长于接受铂类联合依托泊苷治疗的患者。相反,携带RB1和TP53突变的患者对铂类联合依托泊苷的反应优于铂类联合培美曲塞或吉西他滨联合紫杉烷。尽管还需要进一步验证,但这些结果表明,LCNEC的基因组分型可能在未来带来临床获益。
前瞻性、非随机的LANCE研究评估了在LCNEC的一线治疗中,在铂类联合依托泊苷的基础上加用阿替利珠单抗的效果。在中位随访23.3个月期间,阿替利珠单抗联合化疗组的中位PFS和中位OS尚未达到;相比之下,单纯化疗组的中位PFS为5.2个月(p=0.05),中位OS为8.2个月(p=0.04)。目前尚无针对转移性肺LCNEC二线和三线治疗的前瞻性试验,但两项回顾性研究表明,氨柔比星单药可作为肺LCNEC的二线治疗方案,其中位PFS为3.1至4.0个月,中位OS为5.1至9.1个月。
尽管近期针对SCLC的ICI临床试验取得了进展,但仍存在大量未满足的需求。在局限期SCLC(LD-SCLC)中,免疫治疗的作用仍在不断探索。Ⅲ期ADRIATIC试验报道,在同步铂类放化疗后,采用度伐利尤单抗巩固治疗可改善局限期SCLC患者的生存期。
在广泛期SCLC(ES-SCLC)中,两项具有里程碑意义的Ⅲ期试验——IMpower133和CASPIAN,证实了在一线铂类联合依托泊苷化疗中加入ICI的临床获益。IMpower133使阿替利珠单抗获得批准,其中位OS改善从10.3个月延长至12.3个月。CASPIAN试验进一步支持了这一治疗方案,报道度伐利尤单抗组的中位OS为13.0个月,而单纯化疗组为10.3个月。最近,EXTENTORCH试验报道特瑞普利单抗可同时改善PFS和OS,RATIONALE-312试验也报道替雷利珠单抗具有类似的获益。
然而,并非所有试验都取得了阳性结果,且与NSCLC相比,ICI在SCLC治疗中的效果相对不显著。例如,KEYNOTE-604和ECOG-ACRIN 5161(EA5161)试验尚未报道加入ICI能带来获益。此外,与广泛期SCLC试验中约2至3个月的中位OS改善不同,NSCLC的试验(如KEYNOTE-189)报道了更显著的中位OS改善(22.0个月 vs 10.6个月)。在客观缓解率(ORR)方面,一项针对SCLC的荟萃分析发现,加入ICI并未改善客观缓解率,而在NSCLC试验(如KEYNOTE-189)中,ICI联合化疗的ORR高于单纯化疗。这凸显了需要进一步研究以优化ICI在SCLC中的应用。
另一个未满足的需求是二线治疗方案的数量有限且疗效不佳(表2)。直到2020年,复发转移性SCLC唯一的二线治疗方案是拓扑替康,但最近的试验发现芦比替定和塔拉妥单抗在二线治疗中可能具有一定作用。
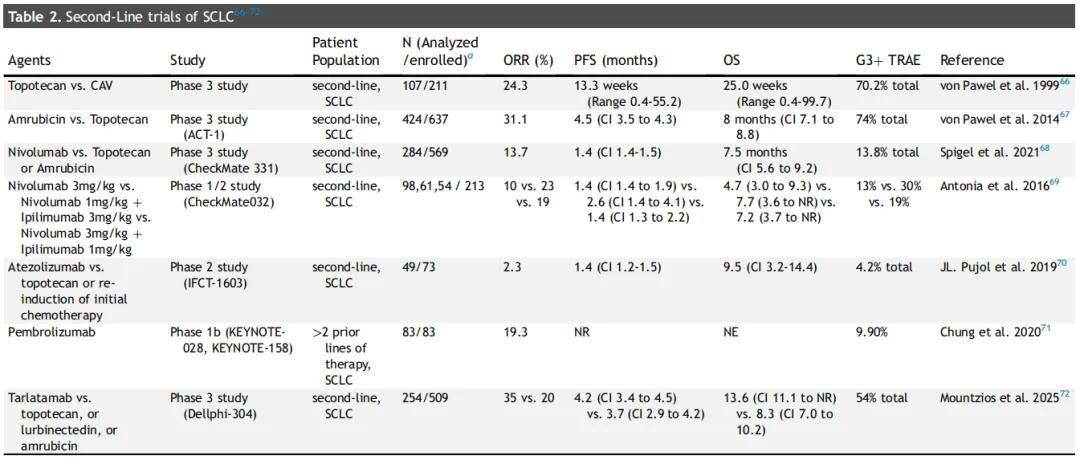
表2
SCLC和LCNEC的新兴疗法
DLL3:
DLL3 是ES-SCLC的潜在治疗靶点。大多数 SCLC(约 80%)中都存在 DLL3 的表达,但正常成人组织中无此表达。特司林-洛伐妥珠单抗(Rovalpituzumab tesirine,Rova-T)是一种抗体-药物偶联物(ADC),最初被认为是靶向 DLL3 的合理治疗方案(表3),但基于其在维持治疗(TAHOE 试验)和二线治疗(MERU 试验)中的阴性结果,该药物的研发已终止。这些研究还报告了较高的治疗中断率。
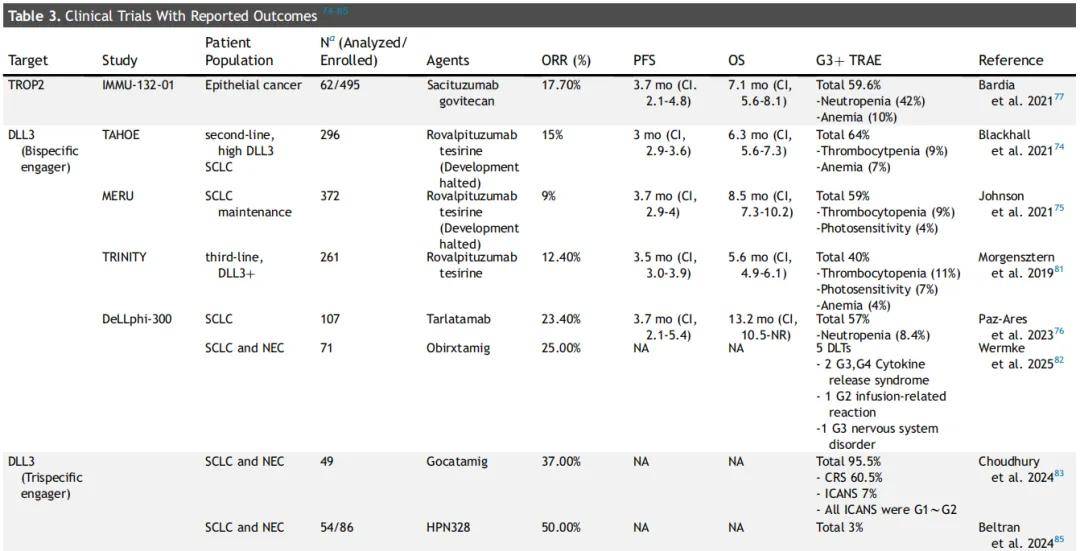
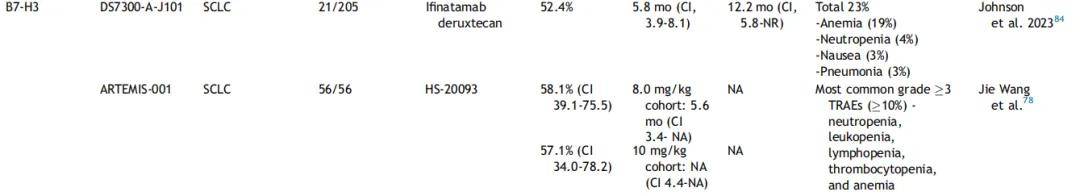

表3
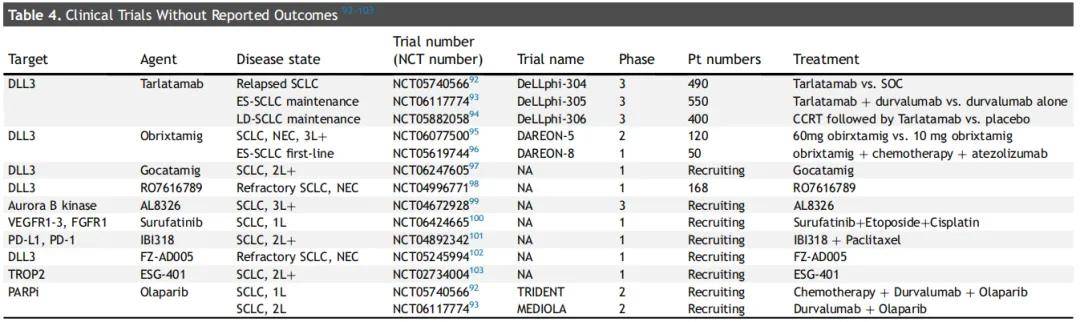
表4
针对DLL3 的研发尝试仍在继续。塔拉妥单抗(tarlatamab,AMG757)是首个靶向 DLL3 的双特异性 T 细胞衔接器(BiTE),可同时结合肿瘤细胞上的 DLL3 和 T 细胞上的 CD3。在塔拉妥单抗治疗 SCLC 患者的 Ⅰ 期试验中,107 例患者接受了剂量探索(0.003 - 100 mg,n=73)和剂量扩展(100 mg,n=34)治疗。该试验未达到最大耐受剂量,ORR为 23.4%,中位缓解持续时间(mDOR)为 12.3 个月。中位PFS和OS分别为 3.7 个月和 13.2 个月(表3)。一项探索性分析表明,DLL3表达水平越高,临床获益程度越大。在 Ⅱ 期试验(DELLphi-301)中,研究评估了塔拉妥单抗的两种不同剂量(10 mg 或 100 mg)。结果显示,10 mg 组的ORR为 40%,100 mg 组为 32%;10 mg 组和 100 mg 组的中位PFS分别为 4.9 个月和 3.9 个月。Ⅰ 期研究的更新数据显示,每 2 周 10 mg 剂量组的中位OS为 20.3 个月,而 100 mg 剂量组的中位OS为 17.5 个月。此外,与 100 mg 剂量相比,10 mg 剂量组患者的持续疾病控制率更高,且 3 级或以上治疗相关不良事件(TRAE)更少。另外,塔拉妥单抗显示出潜在的颅内活性,在基线存在中枢神经系统(CNS)病变且接受过CNS放疗(RT)的患者中,62.5% 观察到中枢神经系统肿瘤缩小。TRAE主要为细胞因子释放综合征和发热,严重程度多为 1 级或 2 级。另一种值得关注的治疗相关不良事件是免疫效应细胞相关神经毒性综合征,其临床表现可能为头痛、谵妄,严重时可出现脑病。这种神经毒性被认为是 T 细胞重定向疗法(如 BiTE 和嵌合抗原受体 T 细胞疗法)的一类效应。基于这些结果,美国FDA已批准塔拉妥单抗用于治疗在铂类化疗期间或之后疾病进展的 ES-SCLC。
目前,Ⅲ 期 DeLLphi-304 试验(NCT05740566)正在评估塔拉妥单抗(每 2 周 10 mg)与标准治疗方案在既往接受过治疗的 ES-SCLC 患者中的疗效。此外,其他正在进行的 Ⅲ 期试验正在探索 塔拉妥单抗在巩固治疗中的作用。DeLLphi-305 试验(NCT06117774)正在评估塔拉妥单抗联合度伐利尤单抗与单药度伐利尤单抗在一线化疗免疫治疗后的 ES-SCLC 患者中的疗效;而 DeLLphi-306 试验(NCT06117774)则在同步放化疗后未进展的LS-SCLC患者中研究塔拉妥单抗的作用。
Obrixtamig 是另一种正在研发的靶向 DLL3 的 BiTE 药物。Obrixtamig 的首次人体 Ⅰ 期试验报告显示,在 90μg/kg 及以上剂量组(n=71)中,ORR为 25%。在 SCLC 患者(n=39)、肺外神经内分泌癌患者(n=27)和 LCNEC 患者(n=5)中,ORR分别为 26%、19% 和 60%。随后一项针对 obrixtamig 治疗 LCNEC 患者(n=14)的报告显示,ORR为 54%,PFS为 3.6 个月。目前,obrixtamig 正在一项开放标签、多中心、剂量选择的 Ⅱ 期 DAREON-5 试验中接受评估,该试验纳入了表达 DLL3 的 SCLC 和肺外神经内分泌癌患者。Gocatamig 是一种三特异性 T 细胞激活构建体,由三个功能域组成:用于 T 细胞衔接的 CD3 结合域、用于延长半衰期的白蛋白结合域,以及用于肿瘤靶向的 DLL3 结合域。一项评估 gocatamig 在既往接受过治疗的 SCLC 患者中疗效的 Ⅰ/Ⅱ 期临床试验取得了令人鼓舞的结果,在脑转移患者中的总ORR为 37%,颅外ORR为 52%。表 3 和表 4 总结了靶向 DLL3 的临床试验,重点列出了已报告结果和未报告结果的试验。
PARP抑制剂与ICI联合治疗:
迄今为止,已有超过23 项临床试验在SCLC背景下研究PARP抑制剂。尽管大多数试验仍处于 Ⅰ 期,但已有少数试验报告了中期结果。TRIDENT 试验是一项单臂、多中心的 Ⅱ 期研究。未接受过治疗的ES-SCLC患者接受度伐利尤单抗联合铂类-依托泊苷治疗,随后接受度伐利尤单抗联合奥拉帕利维持治疗直至疾病进展。中位PFS为 6.8 个月,中位OS为 14.6 个月。MEDIOLA 试验探讨了奥拉帕利联合度伐利尤单抗用于铂类化疗后复发的 SCLC 患者的疗效和安全性,中位 PFS 和 OS 分别为 2.4 个月和 7.6 个月。最常见的AE为贫血(75%)、恶心(47.5%)和疲劳(40%),80% 的患者发生 3 级及以上不良事件。另一项探讨度伐利尤单抗联合奥拉帕利治疗复发 SCLC 患者的研究报告了相似结果,ORR为 10.5%,中位 PFS 为 1.8 个月。
SLFN11 是一种公认的 DNA 和 RNA 解旋酶,可被招募至应激复制叉并不可逆地诱导细胞死亡。有趣的是,其表达与 PARP 抑制剂敏感性相关。在一项针对 SLFN11 阳性 ES-SCLC 患者的 Ⅱ 期随机研究中(西南肿瘤协作组 S1929 试验 [SWOG S1929]),比较了阿替利珠单抗维持治疗与阿替利珠单抗联合他拉唑帕利维持治疗的效果,两组中位 PFS 分别为 2.8 个月和 4.2 个月。此外,两组 3 级及以上血液学毒性存在显著差异:阿替利珠单抗联合他拉唑帕利组为 50%,阿替利珠单抗单药组为 4%;3 级及以上非血液学毒性发生率分别为 17% 和 4%。
鉴于PARP 抑制剂疗效有限且血液学不良事件增加,将其纳入 SCLC 治疗仍面临挑战。进一步优化治疗策略和患者选择或可改善预后。
合成转录抑制剂:
卢比替定(Lurbinectedin)是一种合成的海洋来源生物碱,可阻断激活的转录过程并诱导 DNA 双链断裂,从而导致肿瘤细胞凋亡。Ⅱ 期 BASKET 试验纳入 105 例铂类化疗期间或之后疾病进展的 SCLC 患者,以评估卢比替定的疗效,结果显示 ORR 为 35.2%,中位 PFS 为 3.5 个月,中位 OS 为 9.3 个月。安全性分析中,最常见的 3-4 级不良事件包括血液学异常,如贫血(9%)、白细胞减少(29%)、中性粒细胞减少(46%)和血小板减少(7%),5% 的患者出现发热性中性粒细胞减少。真实世界数据显示,其血液学毒性谱优于拓扑替康等其他二线治疗药物。
卢比替定的联合治疗是另一研究热点。在一项Ⅰ/Ⅱ 期试验(LUPER)中,帕博利珠单抗联合卢比替定用于一线铂类化疗后进展的患者,ORR 为 46.4%,中位 PFS 和 OS 分别为 4.6 个月和 10.5 个月。Ⅲ 期 IMforte 试验在依托泊苷、卡铂联合阿替利珠单抗诱导治疗后的 ES-SCLC 患者中,比较了卢比替定联合阿替利珠单抗维持治疗与阿替利珠单抗单药维持治疗的效果,结果显示联合治疗组 PFS(p<0.0001)和 OS(p=0.017)均获得统计学显著改善。此外,一项 Ⅲ 期试验正在进行中,比较卢比替定单药或联合伊立替康与伊立替康或拓扑替康的疗效(NCT05153239)。
然而,其他探讨卢比替定联合度伐利尤单抗或纳武利尤单抗- 伊匹木单抗的研究因不可接受的毒性(NCT04610658)或招募延迟(NCT05572476)而提前终止。此外,Ⅲ 期 ATLANTIS 试验比较了二线卢比替定联合多柔比星与静脉拓扑替康或环磷酰胺 + 多柔比星 + 长春新碱的疗效,结果显示在复发 SCLC 患者中,卢比替定联合治疗组的 OS 未优于对照组。这些发现表明,尽管卢比替定联合治疗或可成为有前景的二线策略,但仍需进一步研究。
TROP-2:
TROP-2 在癌变和肿瘤进展中至关重要。20% 的高级别神经内分泌肿瘤存在 TROP-2 过表达。过去十年中,已研发出多种靶向 TROP-2 的药物,包括抗体和抗体 - 药物偶联物(ADC)(图 3)。
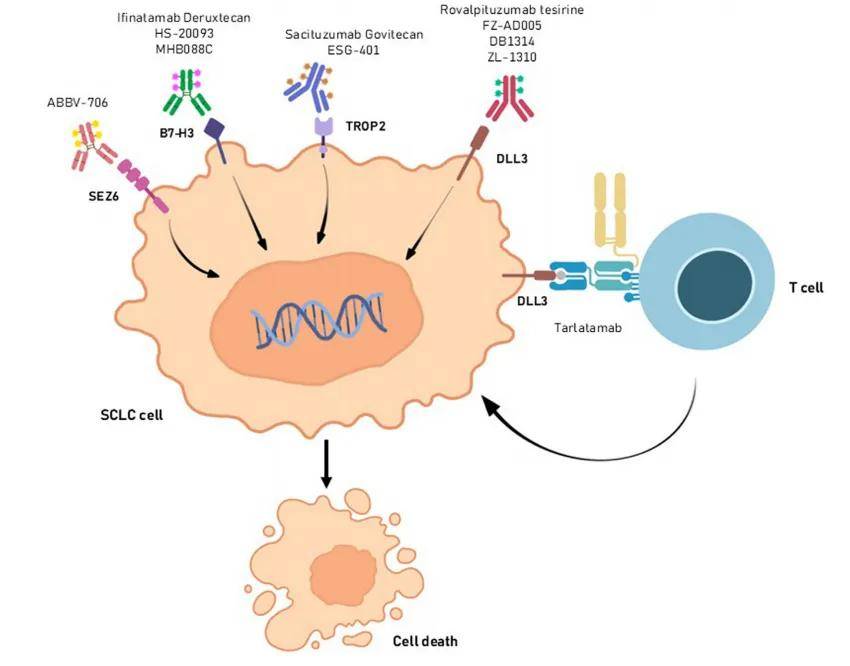

图3
戈沙妥珠单抗(Sacituzumab govitecan):
戈沙妥珠单抗(SG)是美国FDA批准的首个靶向TROP-2 的 ADC,最初用于三阴性转移性乳腺癌,由抗 TROP-2 抗体与拓扑异构酶 Ⅰ 抑制剂 SN-38 偶联而成。在 Ⅰ/Ⅱ 期篮子试验 IMMU-132-01 中,SG 在既往接受过治疗的 ES-SCLC 中显示出抗肿瘤活性。多队列、开放标签的 Ⅱ 期 TROPiCS-03 试验(NCT03964727)纳入经一线铂类化疗和抗PD-1/PD-L1治疗后进展的 ES-SCLC 患者,每 21 天为一个周期,在第 1 天和第 8 天给予 10 mg/kg SG 治疗。研究者评估的 ORR 为 41.9%,中位 PFS 和 OS 分别为 4.40 个月和 13.6 个月。安全性分析(N=43)显示,所有患者均发生TRAE,74.4% 的患者发生 3 级 TRAE,但未出现因 TRAE 导致的治疗中断。另一项正在进行的试验正在评估 SG 作为一线治疗的作用。
ESG-401:
ESG-401(Sorrento Therapeutics 公司,美国加利福尼亚州圣地亚哥)也是一种靶向 TROP2 的 ADC,由人源化单克隆抗体(mAb)与 SG 相同的载荷偶联而成,但连接子未公开。目前,ESG-401 正在一项 Ⅰ/Ⅱ 期研究中评估其对包括 SCLC 在内的晚期或转移性实体瘤的疗效(NCT04892342)。
B7-H3:
B7-H3(CD276)是 B7 免疫检查点分子超家族成员,在多种实体瘤中过表达。约 65% 的 SCLC 肿瘤存在中至高度 B7-H3 表达,且与疾病进展和生存期缩短相关。
Ifinatamab Deruxtecan(I-DXd,DS7300a):
DS7300a 是一种 B7-H3 特异性单克隆抗体与 DNA 拓扑异构酶 Ⅰ 抑制剂 DXd 偶联而成的 ADC。Ⅰ/Ⅱ 期、多队列 IDeate-Pantumor01 试验(NCT04145622)在剂量递增阶段纳入经多线治疗的 ES-SCLC 患者(N=21),给予 6.4-16.0 mg/kg DS7300a 治疗。亚组分析显示 ORR 为 52.4%(95%CI:29.8-74.3),其中 1 例达到完全缓解;中位 PFS 为 5.6 个月(95%CI:3.9-8.1),mDOR为 5.9 个月(95%CI:2.8-7.5);中位 OS 为 12.2 个月(95%CI:6.4 - 未达到 [NA])。未观察到 B7-H3 H 评分(膜和胞质联合评分)与最佳总体缓解、PFS 或 OS 的相关性。B7-H3 水平与临床疗效的关系将在未来 I-DXd 研究中进一步评估。100% 的患者发生任何 TRAE,36.4% 的患者发生 3 级及以上 TRAE,22.7% 的患者因 TRAE 停药。IDeate-Lung01Ⅱ 期试验进一步在 88 例接受过 1-3 线治疗的 ES-SCLC 患者中评估了 DS7300a 的疗效(8 mg/kg 组,n=46;12 mg/kg 组,n=42)。12 mg/kg 组确认 ORR 为 52.4%,8 mg/kg 组为 26.1%。尽管生存数据尚未成熟,但 12 mg/kg 剂量显示出更强的临床活性,因此被选为 Ⅲ 期 Ideate-Lung02 研究的用药剂量(NCT06203210)。
HS-20093:
HS-20093 是一种全人源化抗 B7-H3 单克隆抗体,与拓扑异构酶抑制剂载荷共价连接。ARTEMIS-001 剂量递增和扩展研究纳入未筛选 B7-H3 表达的局部晚期或转移性实体瘤患者,其中 SCLC 患者需接受过既往铂类治疗。通过IHC回顾性评估 B7-H3 表达。基于剂量递增阶段的结果,HS-20093 获得突破性疗法认定。在剂量扩展研究中,56 例 ES-SCLC 患者接受每 3 周 8.0 mg/kg 或 10.0 mg/kg 治疗。8.0 mg/kg 组 ORR 为 58.1%(95%CI:39.1-75.5),DCR为 80.6%(95%CI:62.5-92.5);中位 PFS 为 5.6 个月(95%CI:3.4-NA),mDOR 为 4.3 个月(95%CI:3.3-NA)。10.0 mg/kg 组 ORR 为 57.1%(95%CI:34.0-78.2),DCR 为 95.2%(95%CI:76.2-99.9);中位 PFS 未达到(95%CI:4.4-NA),mDOR 未达到(95%CI:3.1-NA)。最常见的 3 级及以上 TRAE(≥10%)为中性粒细胞减少、白细胞减少、淋巴细胞减少、血小板减少和贫血。一项比较 HS-20093 与标准化疗治疗复发 SCLC 的 Ⅲ 期研究正在计划中。
MHB088C:
MHB088C 是一种研究性 B7H3 靶向 ADC,由人源化抗 B7H3 单克隆抗体与高效 DNA 拓扑异构酶Ⅰ抑制剂(效力比 DXd 高 5-10 倍)偶联而成。首次人体Ⅰ期研究(NCT05652855)纳入经治晚期实体瘤患者,至少接受一剂治疗。剂量递增阶段,MHB088C 静脉给药剂量为每 2 周 0.8、1.6、3.0 mg/kg,以及每 3 周 3.0、4.0 mg/kg。疗效评估包括 31 例 SCLC 患者,ORR 为 61.3%,DCR 为 93.5%(29)。24 例患者中,6 例(19.4%)达到 60% 及以上肿瘤缩小,其中 2 例在 3.0 mg/kg 剂量下实现靶病灶完全缓解。10 例接受每 2 周 1.6 mg/kg 治疗的患者中,ORR 为 80%,DCR 为 90%。总体安全性分析显示,25% 以上患者最常见的 TRAE 为血液学毒性。3 级及以上 TRAE(≥5% 患者)包括中性粒细胞计数降低(33.3%)、淋巴细胞计数降低(30.0%)、白细胞计数降低(26.7%)、血小板计数降低(23.3%)和贫血(15.0%)。未报告间质性肺病。特定肿瘤类型的注册试验预计于年底启动。
YL201:
YL201 是一种靶向 B7-H3 的 ADC,具有肿瘤微环境激活型连接子和拓扑异构酶Ⅰ抑制剂载荷。首次人体Ⅰ期研究纳入至少接受过两线治疗的 SCLC 患者。在接受≥2.0 mg/kg 剂量治疗的可评估患者(n=72)中,确认 ORR 为 63.9%,DCR 为 91.7%,中位 PFS 为 6.3 个月。
最常见的3 级及以上血液学 TRAE 为白细胞减少(29.0%)、中性粒细胞减少(31.7%)和贫血(25.0%)。此外,报告 4 例间质性肺病(1.3%)。值得注意的是,不同肿瘤类型中,IHC 评估的 B7-H3 表达与临床疗效未观察到明确相关性,这表明单独 B7-H3 表达可能不是治疗反应的可靠预测生物标志物。基于其令人鼓舞的抗肿瘤活性,Ⅲ 期临床试验已启动(NCT06612151)。
SEZ6:
ASCL1 是一种神经元前体碱性螺旋-环-螺旋转录因子,在神经发生过程中对神经元细胞身份的确定至关重要。约三分之二的原发性 SCLC 被归类为ASCL1驱动型(SCLC-A+),SEZ6 被确定为 ASCL 的下游靶标。长期暴露于铂类药物后,耐药细胞中 SEZ6 表达上调。
ABBV-706:
ABBV-706 是一种靶向 SEZ6 的 ADC。与其前身 ABBV-011(研发已终止,采用卡奇霉素载荷)不同,ABBV-706 与拓扑异构酶 1 抑制剂载荷偶联。在 Ⅰ 期、开放标签、多中心、剂量递增和扩展研究(NCT05599984)中,ABBV-706 单药或联合布格利单抗(budigalimab,一种PD-1 抑制剂)、卡铂或顺铂给药。纳入至少接受过一线治疗的 SCLC、神经内分泌肿瘤和CNS肿瘤患者。数据截止时,49 例患者(SCLC:22 例 [45%],CNS肿瘤:5 例 [10%],神经内分泌肿瘤:22 例 [45%])接受了 ABBV-706 治疗。15 例 SCLC 患者纳入RECIST评估,ORR 为 40%。总体安全性分析显示,92% 的患者发生TEAE,最常见的为贫血(51%)、疲劳(41%)、中性粒细胞减少(31%)和白细胞减少(31%)。57% 的患者发生 3 级 TEAE,主要为血液学毒性,即中性粒细胞减少(29%)、贫血(27%)和白细胞减少(25%)。
作为ADC靶点的 DLL3:
FZ-AD005:
FZ-AD005 由新型抗 DLL3 抗体 FZ-A038 与缬氨酸 - 丙氨酸(Val-Ala)连接子偶联 DXd 细胞毒性药物而成,在临床前模型中显示出良好活性。一项针对 SCLC 和 LCNEC 患者的Ⅰ期研究(NCT06424665)目前正在招募患者。
DB-1314:
DB-1314 是一种抗 DLL3 ADC,由新型人源化抗 DLL3 单克隆抗体(DB131401)与 8 个拓扑异构酶Ⅰ抑制剂P1021分子偶联而成,在临床前研究中显示出良好的药代动力学和毒代动力学特征。
ZL-1310:
ZL-1310 由人源化抗 DLL3 抗体、蛋白酶敏感型连接子和新型喜树碱衍生物载荷组成。一项针对 SCLC 患者的开放标签、多中心Ⅰ期试验目前正在招募患者(NCT06179069)。
挑战与未来研究方向
DLL3作为LCNEC的新靶点:
DLL3在37%-74%的IV期LCNEC中表达。双特异性CD3与DLL3衔接子Obrixtamig已显示出前景广阔的抗肿瘤活性,在LCNEC中ORR高达83%。24%的患者出现3级或更高等级的TRAE,最常见的3级TRAE为细胞因子释放综合征(3%)。另一项研究报道,塔拉妥单抗在一项病例研究中可诱导持续超过6个月的部分缓解。此外,DLL3与CD47双特异性衔接子peluntamig目前正在招募患者,以评估其在LCNEC中的疗效(NCT05652686)。这些研究表明,靶向DLL3的药物可能在LCNEC中发挥作用。这些发现凸显了DLL3靶向疗法作为LCNEC潜在治疗策略的潜力,值得进一步临床研究。
SCLC的获得性耐药机制:
多年来,细胞毒性抗癌药物一直是SCLC治疗的关键药物。近年来,ICIs和T细胞衔接子已纳入标准治疗。然而,由于这一历史背景,大多数关于SCLC耐药性的研究仍集中于细胞毒性药物。
对细胞毒性抗癌药物的耐药机制:
多项临床前和临床模型显示,SCLC中DNA修复系统与细胞毒性药物耐药性之间存在相互作用,这与其他实体瘤类似。SLFN11是一种与S期检查点相关的蛋白,可不可逆地阻断复制叉进展、开放染色质,并在因DNA损伤剂导致复制压力的细胞中诱导细胞周期停滞。通过免疫组化染色或基因下调发现,对化疗无反应的患者和PDX模型中SLFN11表达降低,提示低水平的SLFN11可能使细胞绕过S期检查点,即使存在DNA损伤仍能存活。此外,由P-糖蛋白(MDR1)和多药耐药相关蛋白(MRP1、MRP2)介导的多药耐药(MDR)在包括SCLC在内的多种癌症中普遍存在。在复发SCLC样本中已鉴定出ABCC1(编码MRP1)的体细胞拷贝数增加以及P-gp和MRP1表达升高。SCLC中的化疗耐药细胞还表现出去分化特征,以CD133表达为标志的具有干细胞样特性的亚群可能在化疗后存活并在治疗后重新增殖。
最近提出的SCLC亚型分类概念为化疗耐药机制提供了新见解。Gay等人报道,SCLC-P亚型对顺铂最敏感,而SCLC-I亚型最耐药。有趣的是,体内模型显示顺铂诱导SCLC-A向SCLC-I表型转化,提示亚型转换可能是获得性铂耐药的机制之一。
对ICIs的耐药机制:
鉴于副肿瘤综合征的高发病率和频繁的重度吸烟史(导致高体细胞突变负荷,理论上支持ICI应答),SCLC被认为具有免疫原性。然而,与其他实体瘤相比,SCLC对ICIs的应答率仍相对较低。一项纳入27项SCLC研究、共2792例患者的荟萃分析显示,PD-L1合并表达率为26.0%,低于NSCLC。免疫细胞(尤其是细胞毒性T细胞)浸润水平低以及PD-L1低表达可能导致SCLC对抗PD-L1治疗的原发性耐药。在最近提出的亚分类中,部分SCLC肿瘤被鉴定为具有炎症性肿瘤特征,但这一比例仍然较低,支持SCLC整体对ICIs耐药的观点。关于SCLC获得性ICI耐药机制的报道较少,可能是由于临床因素(如疾病进展迅速,再次活检困难)所致。
新型化合物的颅内疗效:
脑转移在SCLC中几乎不可避免,因此控制颅内疾病至关重要。ADCs已成为一种有前景的治疗方法,在解决SCLC管理这一关键问题方面显示出潜在疗效。在B7-H3靶向ADC药物I-DXd治疗SCLC的试验中,颅内缓解率显著:8 mg/kg组(n=6)的缓解率为66.7%,疾病控制率为100%;12 mg/kg组(n=10)的缓解率和疾病控制率分别为50%和100%。尽管SG在SCLC中的颅内疗效尚未报道,但其对乳腺癌和胶质母细胞瘤脑转移的作用已被观察到。这些发现提示ADCs可能在治疗SCLC脑转移中发挥作用,进一步的临床试验正在进行中以提供更可靠的数据。
在Dellphi-300试验中,37.5%(3/8例)在塔拉妥单抗给药前至少50天完成放疗的患者出现至少30%的CNS肿瘤缩小。此外,一项真实世界病例系列报道,10例患者中有9例(90%)获得临床获益,并有CNS肿瘤缩小的证据。有趣的是,未接受脑部放疗的患者也出现了这一现象。这些发现表明,T细胞衔接子可能为CNS转移患者带来临床益处,尽管仍需进一步研究。
尽管现有证据表明ADC和双特异性衔接子等新型化合物可能具有颅内活性,但必须强调放疗应继续作为SCLC和LCNEC脑病变治疗的基础。
SCLC和LCNEC治疗是否需要生物标志物选择?
SCLC的亚型概念已引起关注,研究表明SCLC可根据分子特征分为不同亚群。然而,目前尚无前瞻性数据表明亚型特异性治疗比标准疗法疗效更佳。尽管基于NE标志物或特定基因表达提出了多种分类方案,但尚未形成普遍接受的系统。缺乏成熟的标准化分类体系进一步复杂化了基于亚型的治疗策略。
此外,获取足够组织进行全面生物标志物检测具有挑战性;许多SCLC病例仅通过细胞学样本确诊,限制了分子分析的能力。由于SCLC的侵袭性,在启动一线治疗前往往没有足够时间进行广泛分子检测。因此,尽管SCLC亚型驱动治疗前景广阔,但其临床实施受到前瞻性证据不足、分类不一致、活检限制以及因疾病快速进展急需治疗等因素的制约。
LCNEC的分子亚型分类及其亚型特异性治疗的应用仍存在争议。例如,一项研究报道,未携带RB1突变的LCNEC患者接受吉西他滨和紫杉烷治疗的OS长于携带TP53和RB1突变并接受铂-依托泊苷治疗的患者。相反,另一项研究发现,未携带RB1突变的患者接受吉西他滨和紫杉烷-铂治疗的生存期短于接受依托泊苷-铂治疗的患者。最后,尽管既往研究报道STK11和KEAP1突变的LCNEC中DLL3表达上调,且近期obrixtamig的临床试验在LCNEC中显示出令人鼓舞的疗效,但仍需进一步研究阐明生物标志物的作用,并确定亚型指导治疗是否能改善这些肿瘤的预后。
近年来,药物开发取得了前所未有的进展,为NE肺癌(历史上治疗创新进展甚微的疾病)带来了新希望。包括ICIs和ADCs在内的新兴疗法有望改变SCLC的治疗格局,这是数十年来未见的转变。此外,在LCNEC的治疗中实施靶向疗法的兴趣日益增长。然而,耐药性和可靠生物标志物需求等挑战依然存在,凸显了持续研究以充分实现这些有前景疗法益处的重要性。随着我们对SCLC生物学认识的加深,将个性化、有效治疗引入临床实践的机会日益增加,最终将改善患者预后。
参考文献:
Lim SM, Shim JSG, Shim HS, et al. What is on the horizon for the diagnosis and treatment of SCLC and large cell neuroendocrine cancer? J Thorac Oncol.





