随着遗传学研究的最新进展,基因检测在临床实践中的应用日益广泛。本文报告了一例通过基因检测辅助诊断乙状结肠癌局部复发的病例,该病变最初被怀疑为小肠原发性肿瘤。一名 61 岁男性患者于一年半前因IIIB期乙状结肠癌接受了腹腔镜乙状结肠切除术,术后接受了 8 个周期的CAPOX辅助化疗。术后一年半的随访CT扫描显示,回肠末端附近、原结肠吻合口吻合钉线邻近处存在一个小肠肿块。PET成像显示该小肠肿块呈高摄取,但原吻合环部位无显著摄取。基于这些结果,临床怀疑为小肠原发性肿瘤而非乙状结肠癌局部复发,遂行腹腔镜手术。术中发现,距盲肠近端约 30 cm的回肠存在一个炎性肿块,累及原吻合部位的吻合钉。因此,患者接受了回盲部切除术联合原结肠吻合口切除术。大体观显示,切除标本中回肠可见一个 25 mm的 2 型肿瘤,延伸至原大肠吻合部位,而结肠黏膜保持完整。组织病理学检查显示为中分化管状腺癌,与原发乙状结肠癌的组织学特征一致,提示可能为局部复发。为分析回肠肿瘤的起源,研究人员进行了全基因组测序及后续PCR直接测序。结果显示,原发肿瘤与回肠肿瘤在两个关键驱动基因(KRAS c.35G>A和PIK3CA c.1624G>A)中存在相同突变,并在一个过客突变(BBS9 c.2218_2222del,也称乘客突变,非驱动突变)中检测到突变。这些发现证实,该回肠肿瘤为局部复发而非新发原发性恶性肿瘤。本例突显了基因检测在临床实践中的实际应用价值,尤其在临床诊断与组织病理学结果不明确或矛盾时。
背 景
近年来,遗传学研究的进展使基因分析不仅在研究领域,而且在临床实践中成为一种潜在的重要工具。由于癌症日益被视为一种“基因组疾病”,基因检测在肿瘤学领域已占据重要地位。尽管其重要性已得到认可,但在日常临床实践中常规实施基因分析仍面临挑战。高昂的成本、检测途径有限,以及临床医生和患者对其缺乏熟悉度与接受度等障碍,阻碍了其更广泛的应用。从展示基因分析实际应用的病例报告中学习,有助于降低这些障碍,并促进其在临床决策中的应用。本文报告了一例通过基因检测辅助诊断乙状结肠切除术后局部复发的病例,该病变最初被怀疑为小肠原发性肿瘤。通过结合全基因组测序与靶向PCR测序,本例阐明了基因分析如何能够有效整合到临床实践中,以实现准确诊断。
病 例
患者男,59 岁,因下腹部及上腹部疼痛就诊。结肠镜检查显示乙状结肠存在环形狭窄,导致内镜无法通过该狭窄段。术前诊断为乙状结肠癌,患者接受了腹腔镜手术。术中发现乙状结肠近乙状结肠-降结肠交界处有一肿块,肉眼可见侵犯腹壁,因此需在切除乙状结肠的同时行腹壁部分切除术。肿瘤周围无邻近的小肠肠袢。手术方式为腹腔镜乙状结肠切除术联合腹壁部分切除及D3淋巴结清扫术。切除标本显示为一环形肿瘤,大小 40×35 mm,近端切缘 10 cm,远端切缘 14 cm。病理学评估显示为中分化管状腺癌,伴部分低分化成分。根据国际癌症控制联盟(UICC)TNM分类(第 8 版),肿瘤分期为pT4a N1b(35 枚淋巴结中 2 枚阳性)M0,对应IIIB期。最终病理确认肿瘤为T4a期,无膀胱镜下侵犯,环周切缘阴性,提示R0切除。基因突变分析显示KRAS G12D阳性、BRAF V600E阴性,微卫星稳定(MSS)。患者接受了CAPOX方案辅助化疗(卡培他滨联合奥沙利铂,共 8 个周期)。术后一年半的随访CT扫描显示,回肠末端附近、原结肠吻合口吻合钉线邻近处存在一个小肠肿块,并伴有淋巴结肿大迹象(图1A)。轴位PET成像显示,“狗耳”状吻合钉线附近小肠壁增厚处呈高摄取(图1B、C),但原吻合环部位无显著摄取(图1D)。包括肿瘤标志物(CEA和CA19-9)在内的血液检查结果无异常。基于这些发现,临床怀疑为小肠原发性肿瘤而非乙状结肠癌局部复发,遂行腹腔镜手术。术中发现,距盲肠近端约 30 cm的回肠存在一个炎性肿块,累及原吻合部位的吻合钉。因此,患者接受了回盲部切除术联合原结肠吻合口切除术。
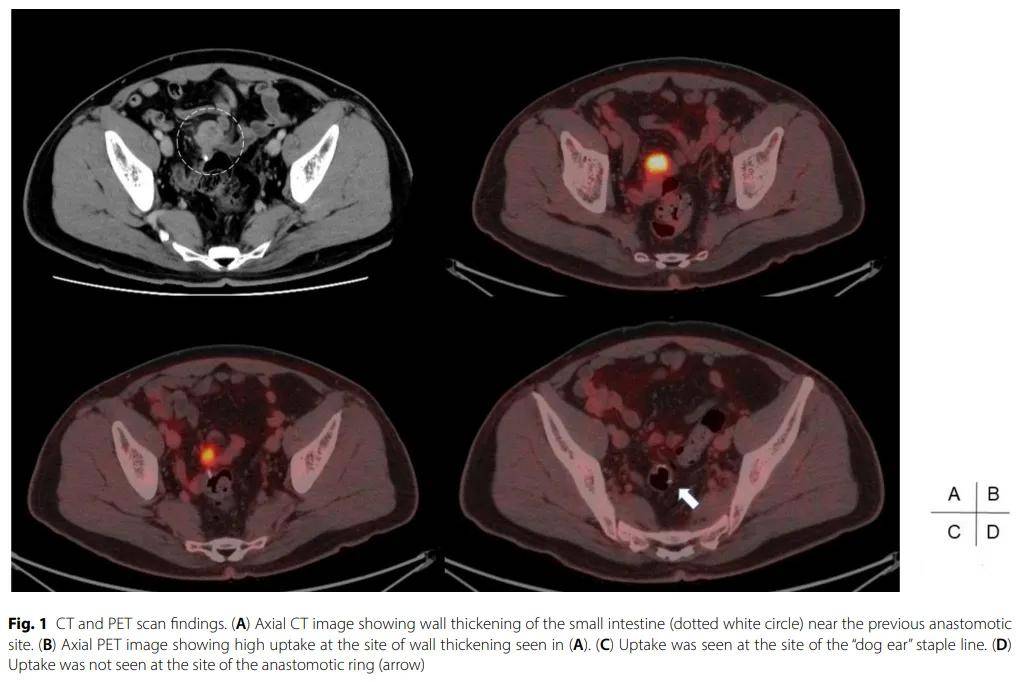
▲图1 CT和PET结果
切除标本显示回肠存在一个 25 mm的溃疡性肿瘤(切缘清晰),该肿瘤延伸至原大肠吻合部位。大体观显示,结肠黏膜保持完整,无肿瘤暴露。基于这些结果,临床怀疑为小肠原发性肿瘤。然而,组织病理学检查发现肿瘤呈筛状结构,提示为中分化管状腺癌(伴部分低分化成分),其组织学特征与初次手术标本观察到的特征相似。该肿瘤起源于大肠固有层,延伸至浆膜下层,并暴露于小肠黏膜表面(图4A、B)。42 枚淋巴结中未观察到淋巴结转移。这些发现提示该病变可能为局部复发。
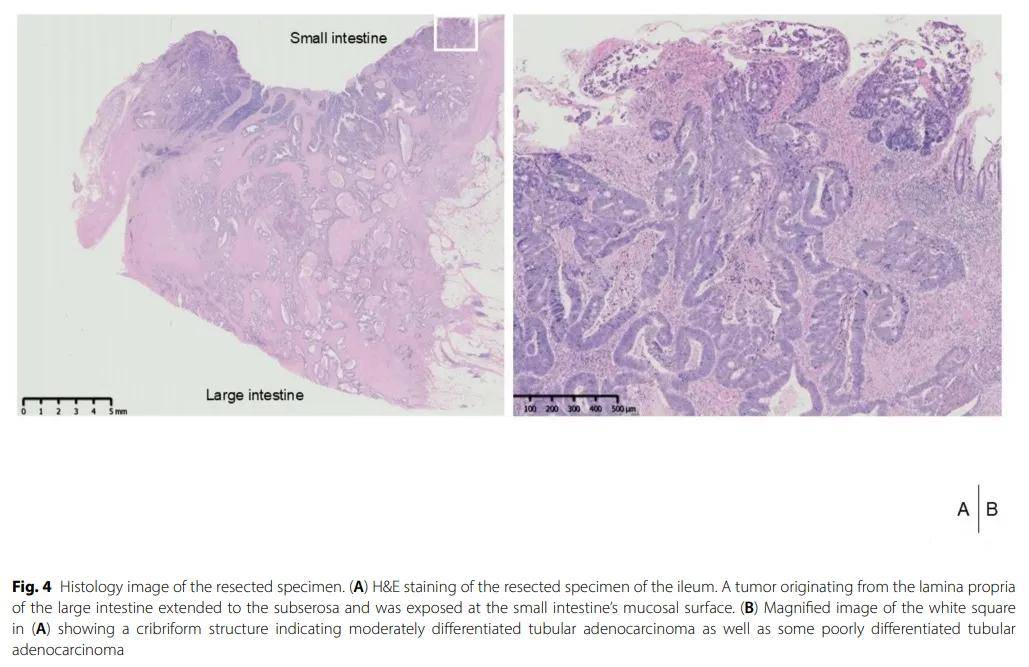
▲图4 切除样本的组织学结果
为探究这一可能性,研究人员对三份样本进行了基因检测,包括首次手术获取组织中的乙状结肠癌样本(T1)、二次手术获取的回肠肿瘤样本(T2)及非癌性结肠黏膜样本(N)。对T2和N样本的全基因组测序显示,T2中存在两种驱动突变:KRAS c.35G>A(p.G12D)和PIK3CA c.1624G>A(p.E542K),其变异丰度分别为 0.43 和 0.39。除这两种驱动突变外,研究人员还检出若干潜在的过客突变(passenger mutation,也称乘客突变、非驱动突变),包括BBS9 c.2218_2222del(p.L740Afs*4),其变异丰度为 0.35。为验证这些突变的存在与否,研究人员通过Sanger测序法对N、T1和T2样本的DNA进行了PCR测序(图5)。如四色电泳图所示(腺嘌呤:绿色;胸腺嘧啶:红色;鸟嘌呤:蓝色;胞嘧啶:青绿色),T1和T2样本(而非正常样本N)中存在上述三个基因的体细胞突变,表明两种肿瘤起源于同一来源。这些发现证实,该回肠肿瘤是乙状结肠癌的局部复发,而非新发原发性恶性肿瘤。因此,患者接受了为期 6 个月的辅助化疗。
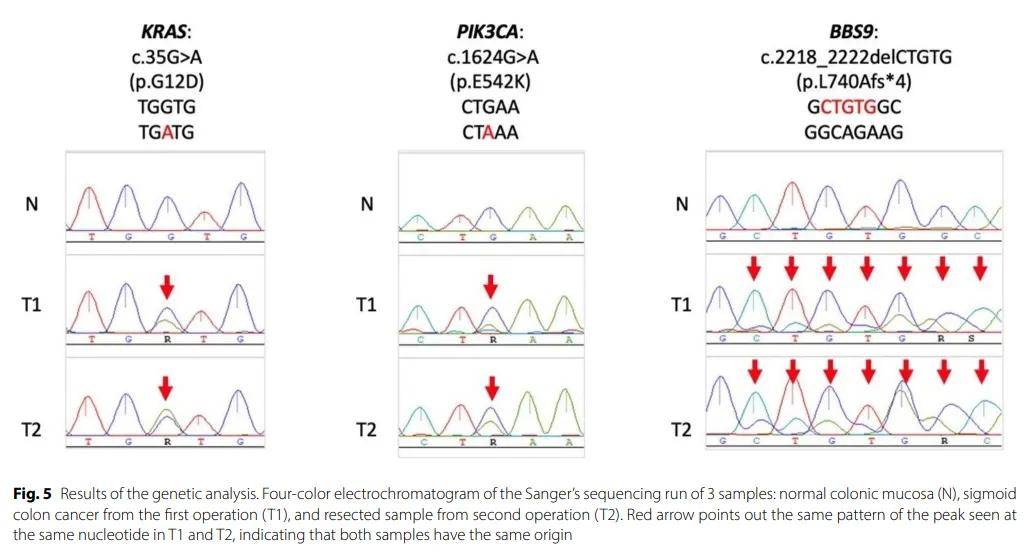
▲图5 基因检测结果
术后恢复顺利,7 天后出院。截至二次手术后 1 年随访时,患者仍无局部复发及远端转移。
讨 论
本文介绍了一例晚期乙状结肠癌局部复发的病例,其表现类似于小肠原发性肿瘤。该病例值得关注,因为所有临床特征(包括术前评估、术中发现及术后大体观评估)最初均提示为小肠原发性肿瘤。然而,组织学检查提示存在局部复发的可能,而最终诊断——局部复发而非小肠原发性肿瘤——通过基因检测得以确认。这一鉴别至关重要,因为它促使患者接受了为期 6 个月的辅助化疗。若诊断为无淋巴结转移的小肠原发性癌,则不会实施辅助化疗。本例阐明了基因检测在日常临床实践中的潜在作用。
小肠肿瘤较为罕见,仅占新发癌症的 0.6%,约占所有胃肠道肿瘤的 3%。多原发癌的发生率也极低。因此,从统计学角度看,本例为小肠原发性肿瘤合并异时性双癌(多原发癌)的可能性极小。然而,本例最初表现为小肠原发性肿瘤。这一假设基于以下几点:首先,CT和PET扫描显示病变位于小肠,而非大肠吻合部位;其次,术中发现小肠存在炎性肿块;第三,术后大体观检查显示小肠黏膜表面存在 2 型病变,但大肠黏膜表面未发现。基于这些观察,推测肿瘤起源于小肠并侵犯邻近大肠,提示不同部位多原发癌的可能似乎合理。另一方面,乙状结肠癌局部复发并不罕见。D’Souza等人于 2016 年开展的系统综述和荟萃分析显示,乙状结肠癌的局部复发率为 10.5%,高于直肠癌。这一统计数据进一步支持了研究人员基于基因检测得出的局部复发的最终诊断。
尽管肿瘤暴露于小肠黏膜表面而非大肠黏膜表面,但组织学发现仍支持局部复发的诊断。二次手术标本主要显示筛状结构(中分化腺癌的特征),部分区域可见出芽及低分化成分。这种分化模式与首次手术标本中观察到的特征相似。肿瘤暴露于小肠黏膜表面而非大肠黏膜表面的原因可能是:肿瘤起源于大肠固有层,以黏膜下肿瘤的形式延伸至小肠,最终逐渐暴露于小肠黏膜表面。然而,仅基于组织学发现无法最终证实这一理论。
在本文病例中,基因检测是明确肿瘤起源(即判断其为小肠原发性肿瘤还是乙状结肠癌局部复发)的决定性检查。研究人员未选择基因panel测序,而是对二次样本(T2)进行了全基因组测序,以同时识别驱动突变和过客突变。随后将这些突变与COSMIC数据库进行比对。在T2样本中,研究人员选择BBS9 c.2218_2222del突变作为过客突变,因其未在COSMIC数据库中被报道或收录。由于两个肿瘤(T1和T2)存在三个相同的基因突变,研究人员最终判定二次手术肿瘤为首次手术肿瘤的局部复发。这种方法的有效性在于,可在二次肿瘤中检测体细胞单核苷酸变异及包括拷贝数变异在内的结构变异,这可能有助于选择治疗方案(尽管其成本高于基因panel测序)。此外,可通过液体活检将突变数据应用于术后疾病复发的监测。
基因分析使我们得以明确诊断,否则这一诊断将难以确定。近年来,基因分析在临床实践中的重要性日益提升。Ikushima等人报道的类似病例中,一名有宫颈鳞状细胞癌病史的患者出现回肠鳞状细胞癌,全基因组测序显示两种肿瘤因转分化起源相同。尽管全基因组测序目前仍限于少数机构且成本较高,但如本例所示,将其与PCR直接测序结合,可能在不久的将来使其在日常临床实践中更易获取和应用。
随着基因检测临床应用的不断拓展,其效过已不局限于肿瘤复发检测。一个显著的应用是药物基因组学——通过基因检测识别存在药物不良反应风险的患者,并实现药物治疗的个体化以提高疗效(尤其在抗血小板治疗中)。此外,基因检测在诊断既往未识别的疾病中具有不可替代的价值,特别是在传统诊断方法无法明确的病例中。这在新生儿中尤为有益,基因检测可实现早期精准诊断。再者,基因检测在风险评估和预防医学中发挥关键作用。通过识别遗传性癌症易感个体,临床医生可实施个体化管理策略(包括预防性手术以降低癌症风险)。这些实例凸显了基因医学的拓展及其对临床实践日益增长的影响。
总结而言,本文介绍了一例在基因检测前肿瘤起源不明的病例。这强调了在临床实践中考虑基因分析的重要性——它可为其他检查无法明确的疾病提供诊断依据。
参考文献:
Ito G, Ota Y, Yamaguchi K, Furukawa Y, Mochizuki S, Ahiko Y, Shida D. Genetic analysis for diagnosing local recurrence of sigmoid colon cancer mimicking a small intestinal tumor: a case report. World J Surg Oncol. 2025 Feb 18;23(1):57. doi: 10.1186/s12957-025-03706-4. PMID: 39966961; PMCID: PMC11834688.





